Система Molecular Mouse: новый эффективный инструмент для управления антимикробной терапией у пациентов в критическом состоянии с сепсисом
Инфекция кровотока (ИК) является серьезной проблемой для здравоохранения во всем мире.
Наличие положительных посевов крови у пациентов с системными признаками инфекции может быть как первичным, так и вторичным по отношению к документально подтвержденному источнику инфекции и может привести к сепсису, органной недостаточности и смерти. В случае сепсиса своевременное выявление ответственного возбудителя имеет важное значение для проведения соответствующей антимикробной терапии и улучшения результатов лечения пациентов. Более того, растущая распространенность как грамположительных, так и грамотрицательных микроорганизмов с множественной лекарственной устойчивостью (МЛУ) представляет собой одну из серьезнейших проблем, препятствующих эффективности терапевтических методов лечения ИК.
Традиционные методы, основанные на культивировании, остаются важными, но они постепенно дополняются более быстрыми фенотипическими методами (например, идентификация и тестирование на чувствительность к противомикробным препаратам, проводимые непосредственно из положительного посева крови или после кратковременного культивирования на твердой среде) и/или быстрыми молекулярными методами. В частности, в рутинном рабочем процессе были применены новые молекулярные подходы, позволяющие быстро идентифицировать профили потенциальной резистентности и обеспечить адекватность целенаправленной терапии.
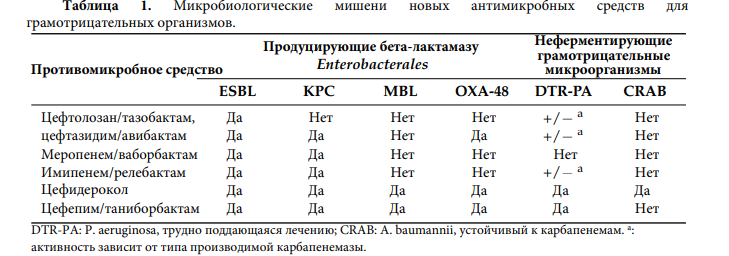
Расширенная характеристика генов резистентности представляет дополнительную ценность для соответствующей терапии, учитывая, что новые коммерчески доступные антимикробные препараты (включая цефтолозан/тазобактам, цефтазидим/авибактам, меропенем/ваборбактам, имипенем/релеобактам, цефидерокол и, совсем недавно, цефепим/таниборбактам) обладают специфической антимикробной активностью в отношении грамотрицательных микроорганизмов, в зависимости от продуцируемого фермента (ов). Важно отметить, что большинство из них включают ингибиторы, которые защищают ассоциированный препарат (например, цефалоспорин или карбапенем) от различных типов карбапенемаз (например, KPC, IMP, VIM, NDM или OXA-48-подобные типы).
Цефтолозан/тазобактам - это новая комбинация бета-лактамов/бета-лактамазных ингибиторов, обладающая активностью в отношении некоторых грамотрицательных микроорганизмов, включая энтеробактерии, продуцирующие бета-лактамазу расширенного спектра действия (ESBL), а также MDR и Pseudomonas aeruginosa с широкой лекарственной устойчивостью, но не действующая на штаммы, продуцирующие карбапенемазу. Другая комбинация бета-лактама и ингибитора бета-лактамазы представлена цефтазидимом/авибактамом. Эта молекула активна в отношении беталактамаз Ambler класса A, класса C и некоторых бета-лактамаз класса D, представляя собой средство первой линии против энтеробактерий, продуцирующих KPC или OXA-48, и альтернативу против энтеробактерий, продуцирующих ESBL или AmpC, и P. aeruginosa.
Аналогичным образом, меропенем/ваборбактам представляет собой комбинацию бета-лактамов/бета-лактамазных ингибиторов, которая действует против бета-лактамаз класса А (включая ESBL и KPC) и С, но неактивна в отношении ферментов класса В и D. Имипенем/циластатин/релебактам представляет собой комбинацию из трех молекул (карбапенем, циластатин и ингибитор бета-лактамаз), активных в отношении грамотрицательных бактерий, как ферментирующих, так и неферментирующих лактозу, включая штаммы, продуцирующие ESBL, KPC и AmpC, но не в отношении тех, которые продуцируют OXA-48.
Ранее описанные молекулы не активны в отношении Acinetobacter baumannii и продуцирующих металло-бета-лактамаз (MBL) грамотрицательных микроорганизмов. Кроме того, цефидерокол - это новый антибиотик, сидерофорный цефалоспорин, активный в отношении широкого спектра грамотрицательных патогенов, таких как ESBL и штаммы, продуцирующие карбапенемазы (включая KPC, сериновые бета-лактамазы типа OXA и MBL). Цефидерокол состоит из комплекса лекарственного средства и железа, способного проникать в клетку патогена как с помощью поринов, так и с помощью системы переноса железа; на него не влияет избыточная экспрессия изотонического насоса.
Таким образом, достигаются высокие концентрации в периплазматическом пространстве. Последняя комбинация бета-лактамов/ингибиторов бета-лактамаз представлена цефепимом/таниборбактамом. Он активен в отношении бета-лактамаз класса А и класса С, а также металло-бета-лактамаз класса В, включая VIM и NDM, но не ферменты типа IMP. Таниборбактам действует как обратимый ковалентный ингибитор сериновых бета-лактамаз и как конкурентный ингибитор MBLs, восстанавливая активность антибиотика против многих МЛУ- и трудноизлечимых
резистентных микроорганизмов (DTR).
В таблице 1 приведены микробиологические мишени новых противомикробных средств, имеющихся в продаже для борьбы с грамотрицательными организмами. Аналогичным образом, в случае грамположительных микроорганизмов оритаванцин и тедизолид являются новыми антимикробными средствами, обладающими активностью в отношении энтерококков, устойчивых к ванкомицину vanA и vanB (VRE).
В этом контексте мы оценили потенциальную роль системы Molecular Mouse в проведении антимикробной терапии пациентов в критическом состоянии с сепсисом, особенно в отношении штаммов МЛУ. Мы также изучили соответствие между результатами, полученными с помощью молекулярного теста, и результатами, полученными с помощью обычного микробиологического метода.
В целом, с мая 2023 по январь 2024 года у пациентов в критическом состоянии с сепсисом было собрано 100 положительных культур крови, которые были проанализированы с использованием Molecular Mouse и стандартных протоколов. Новый инструмент неизменно соответствовал стандартным рутинным методам в случае мономикробных культур крови, в то время как в полимикробных образцах были получены некоторые расхождения.
Гены устойчивости к противомикробным препаратам были обнаружены в 35 образцах, причем наиболее часто выявляемыми мишенями были vanA и группа CTX-M-1/9. Терапия была скорректирована у 42 пациентов в критическом состоянии, что подтверждает важность новых быстрых молекулярных тестов для исследования положительных посевов крови, для корректировки эмпирической терапии и точного применения новых антибиотиков.
Основные преимущества молекулярных систем, безусловно, связаны с сокращением времени, необходимого для идентификации микроорганизмов, и, в конечном счете, с наличием генов устойчивости; информация о механизмах идентификации и устойчивости доступна, соответственно, по крайней мере, за 3 и 24 часа до получения результатов культивирования. В частности, три картриджа, протестированные на системе Molecular Mouse, продемонстрировали хорошие аналитические характеристики по сравнению с классическим методом культивирования.
Кроме того, основное преимущество системы Molecular Mouse заключается в модульной конфигурации теста; с помощью одного программного обеспечения можно выполнять до шести анализов. Один образец можно тестировать одновременно на разных картриджах, а образцы, взятые у разных пациентов, можно тестировать вместе. Кроме того, возможность выбора чипов для тестирования на основе микроскопического исследования, безусловно, снижает затраты на анализ.
Помимо демонстрации аналитических характеристик метода, основной силой этого исследования является анализ влияния результатов тестирования на Molecular Mouse на клиническую практику у тяжелобольных пациентов (например, пациентов из отделений интенсивной терапии, онкологических больных). Было продемонстрировано, что быстрая идентификация микроорганизмов и, в конечном счете, генов резистентности в положительных культурах крови оказывает важное влияние на назначение соответствующей терапии более чем в 60% случаев.
В заключение, наши данные демонстрируют, что Molecular Mouse система обладает потенциалом для ранней и точной диагностики возбудителей инфекции кровотока. В частности, молекулярное определение генов резистентности может быстро повысить эффективность выбора подходящей противомикробной терапии, всего за один час после получения положительного результата анализа крови. Дальнейшие исследования позволят оценить другие картриджи прибора и клинические результаты.
От редакции: система MOLECULAR MOUSE в настоящее время проходит клинические испытания в ФГБНУ РНЦХ им. акад. Б.В. Петровского для дальнейшей регистрации в качестве медицинского изделия. Полный текст статьи прилагается.
Более подробно о системе Molecular Mouse в нашем каталоге.