Биологи ФИЦ Биотехнологии РАН совместно с коллегами из Института биомедицинской химии исследовали свойства новой L-аспарагиназы из гипертермофильной археи Thermococcus sibiricus, обитающей в высокотемпературном нефтяном месторождении в Сибири на глубине более двух тысяч метров.
Этот биотехнологически значимый фермент используется в пищевой промышленности, при создании биосенсоров, а также в медицине благодаря своей противоопухолевой активности. Впервые охарактеризованная авторами L-аспарагиназа отличается от известных аналогов повышенной стабильностью и избирательной токсичностью в отношении раковых клеток. С результатами работы можно ознакомиться в International Journal of Molecular Sciences.
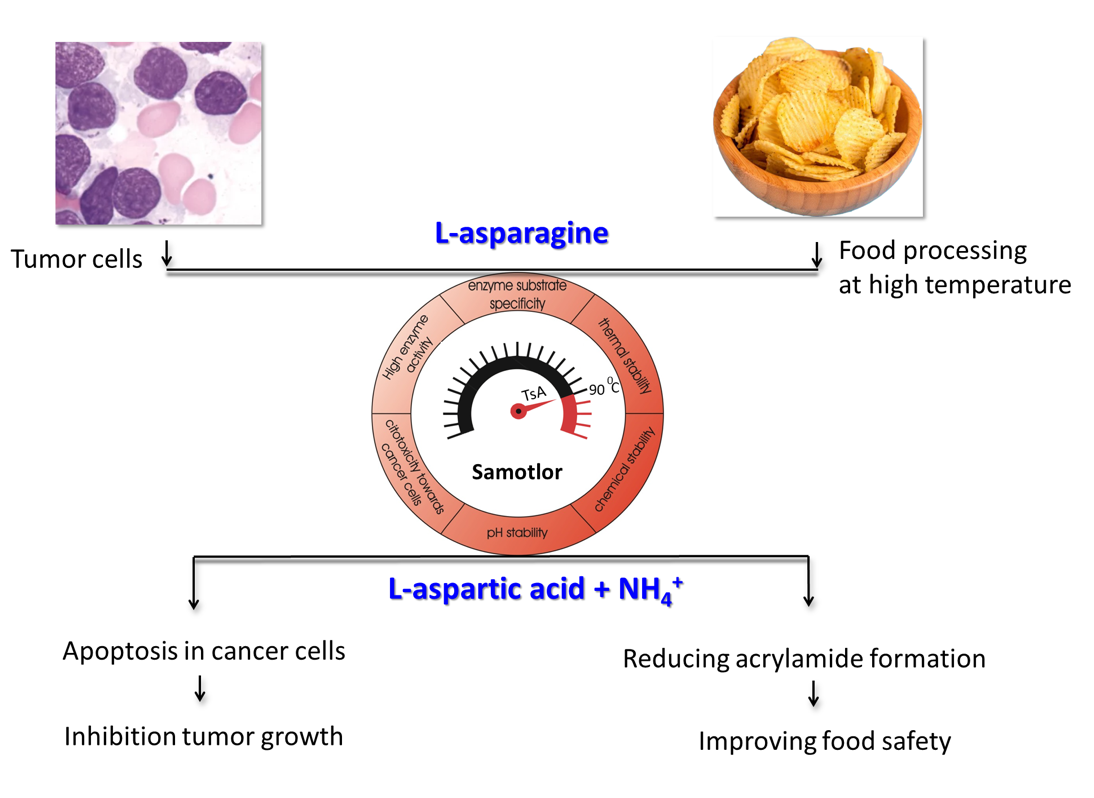
L-аспарагиназа — чрезвычайно важный фермент, который ускоряет расщепление аминокислоты L-аспарагина до L-аспарагиновой кислоты и аммиака. Биотехнологическую значимость фермента подтверждает, прежде всего, многолетнее успешное применение в терапии некоторых видов опухолей. В последнее время возрос интерес к использованию L-аспарагиназ в пищевой промышленности для предотвращения образования в пищевых продуктах, таких как чипсы, выпечка, обжаренный кофе и т.п., потенциального канцерогена – акриламида. Еще одним направлением использования фермента является создание на его основе биосенсоров для определения в образцах уровня L-аспарагина.
Исторически это первый фермент, для которого была обнаружена противоопухолевая активность и который применяется клинически. Клетки некоторых опухолей не способны сами синтезировать L-аспарагин, поэму нуждаются в его доставке извне для роста и размножения. Расщепление L-аспарагина под действием L-аспарагиназы приводит к дефициту этой аминокислоты и, впоследствии, к гибели раковых клеток.
«Несмотря на выраженный терапевтический эффект, у используемых в настоящее время аспарагиназ есть несколько серьезных недостатков. Среди основных - недостаточная стабильность, низкая субстратная специфичность. Часто в результате серьезных побочных реакций приходится отказываться от препарата при онкотерапии".
В этой связи в качестве перспективной альтернативы имеющимся ферментам видятся высокостабильные аспарагиназы из микроорганизмов, обитающих в экстремальных условиях. Эти белки проявляют уникальные свойства»,
— рассказывает один из авторов исследования Мария Думина, к.б.н., научный сотрудник группы генетической инженерии грибов ФИЦ Биотехнологии РАН.
Сотрудники ФИЦ Биотехнологии РАН совместно с коллегами из Института биомедицинской химии исследовали новую аспарагиназу из гипертермофильной археи Thermococcus sibiricus, обитающей в Самотлорском нефтяном месторождении, одном из крупнейших в Сибири, на глубине 2 350 метров. Ученые наработали белок в клетках кишечной палочки, выделили и проверили свойства в разных условиях. Фермент оказался наиболее активен при 90°С — при температуре чуть ниже обитает T. sibiricus — и щелочных значениях рН. Вместе с тем он сохраняет высокую активность в широком диапазоне температур и рН. Также он устойчив к присутствию ионов ряда металлов и мочевины (может быть в биологических образцах). Также авторы проверили действие новой L-аспарагиназы на клеточные культуры. Она подавляла рост различных типов раковых клеток, но при этом практически не влияла на нормальные фибробласты — основные производители межклеточного вещества тканей.
«Наши результаты показывают, что эта аспарагиназа может служить хорошей альтернативой применяемым сейчас ферментам: она активна в широком диапазоне температур и рН, устойчива к ионам металлов, а еще избирательно токсична для опухолей. Это позволяет использовать ее как минимум в биохимии. Теперь нужно проверить аспарагиназу в экспериментах на животных — по итогам таких работ мы сможем говорить о внедрении белка в медицинскую практику», — подводит итог один из авторов статьи, старший научный сотрудник, руководитель группы генетической инженерии грибов ФИЦ Биотехнологии РАН Александр Жгун.