Взаимодействие хозяина и патогена динамично по своей природе и часто модулируется сопутствующими патогенами, играющими функциональную роль в определении физиологического исхода инфекции.
Коинфекция может проявляться либо в виде уже существующего патогена, который усиливается при внедрении нового патогена, либо в виде новой инфекции, приобретенной вторично из-за ослабленной иммунной системы. На примере таких патогенов, как вирус иммунодефицита человека, микобактерии туберкулеза и вирус гепатита С, мы рассмотрели роль коинфекции в модуляции тяжести заболевания и клинического исхода.
Это взаимодействие происходит на нескольких иерархических уровнях, которые включают стресс и иммунологические реакции и вместе модулируют тяжесть заболевания. Уже опубликованная литература предоставляет много доказательств в пользу возникновения коинфекций во время инфекции SARS-CoV-2, что в конечном итоге влияет на исход коронавирусной болезни-19. Доступность биологических моделей, таких как 3D органоиды, мыши, клеточные линии и математические модели, дает нам возможность понять роль и механизм конкретных ко-инфекций. Изучение взаимодействий между патогенами, совместно инфицирующими человека, на основе мультиомики может дать более глубокое понимание их роли в модуляции заболевания.
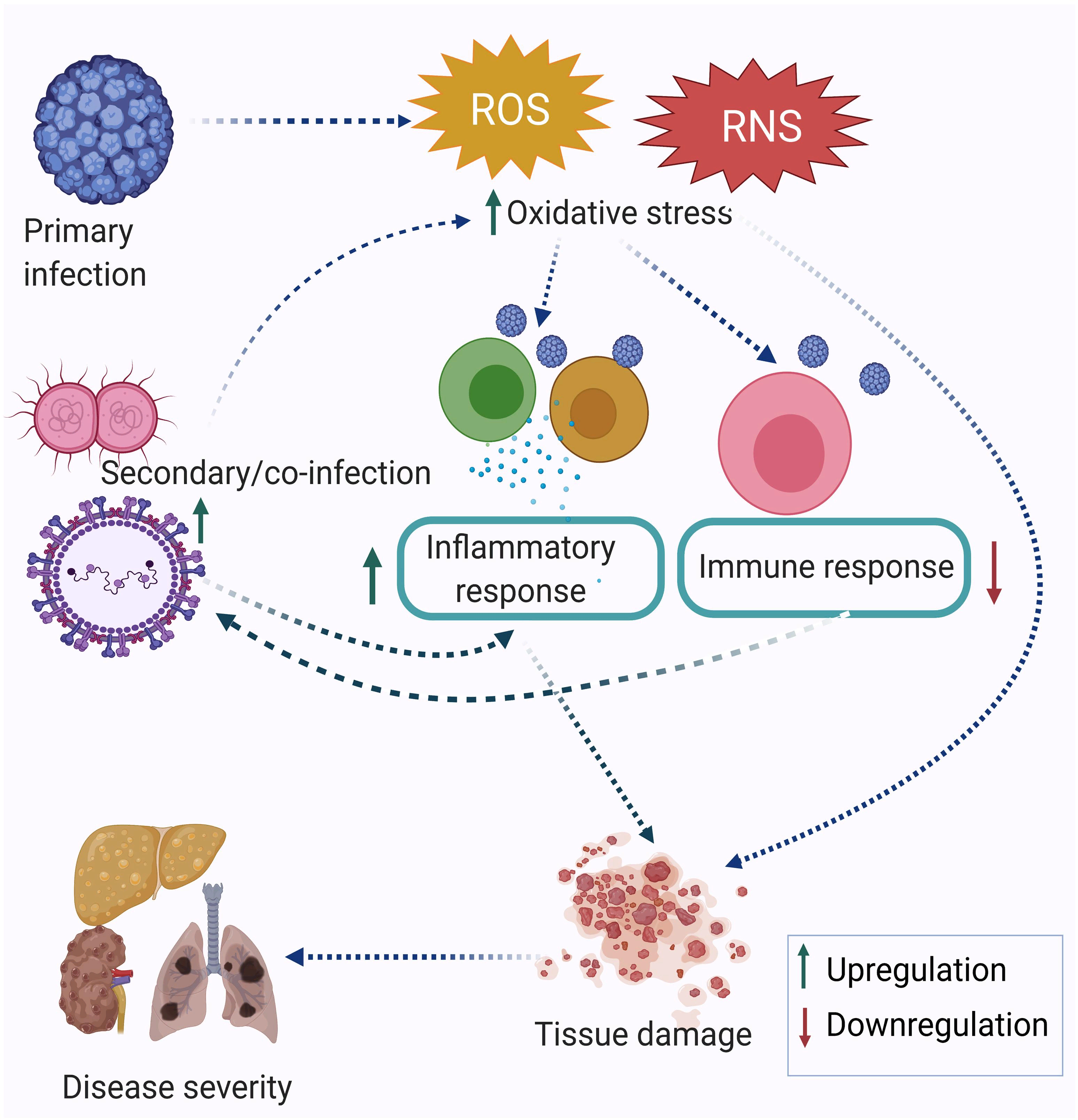
Коинфекция модулирует окислительный стресс, иммунный ответ и тяжесть заболевания. Первичная инфекция приводит к увеличению окислительного стресса, который еще больше усиливается при вторичной инфекции и в конечном итоге приводит к дисрегуляции иммунного ответа. В совокупности это приводит к повреждению тканей и развитию острого заболевания.
Биология коинфекции, как известно, модулируется характером взаимодействия на многочисленных иерархических уровнях между взаимодействующими микроорганизмами внутри общего хозяина, что объясняет сложную нелинейную динамику тяжести инфекционных заболеваний и клинических исходов. Степень взаимодействия или ингибирования между взаимозависимыми патогенами, зависящая от совместно инфицирующих видов, в свою очередь, определяет тяжесть заболевания. Механистическое понимание природы этих взаимодействий, будь то синергизм или антагонизм, имеет важные последствия для принятия решений о лечении. Взаимодействие между микробами на клеточном уровне обусловлено множеством факторов.
Изменения в презентации рецепторов на клеточной поверхности могут быть изменены патогеном, что, в свою очередь, может привести к подавлению или исключению суперинфекции. Динамика совместного инфицирования патогенов в организме хозяина определяется экологическими ограничениями, включая ограничение ресурсов и пространства. Совместно инфицирующие микроорганизмы модулируют исходы инфекции, изменяя характер и степень иммунологического ответа в организме хозяина. Классическим примером является ВИЧ-инфекция, которая нарушает иммунную систему хозяина и тем самым делает его более восприимчивым к коинфекции другими оппортунистическими патогенами. На уровне хозяина межпатогенные взаимодействия могут привести к изменению эпидемиологии заболевания, влияя на летальность и заболеваемость, связанные с инфекционным заболеванием.
Коинфекция увеличивает возможность генетической рекомбинации и реассортации, что приводит к появлению новых антигенных вариантов, влияющих на эффективность лекарственных препаратов, схем лечения и вакцин. В редчайших случаях это может даже привести к развитию новых зоонозных инфекций. Биология коинфекции также важна для оценки характера ответа на фармакологические вмешательства. Пациенты с сопутствующими инфекциями, подвергаясь противомикробной химиотерапии, могут способствовать появлению видов с множественной лекарственной устойчивостью и распространению резистентности к противомикробным препаратам (AMR). Поэтому последствия коинфекций на уровне популяции важно учитывать при разработке, оптимизации и осуществлении мероприятий в области общественного здравоохранения по диагностике, терапии, профилактике и прогнозированию инфекционных заболеваний. Нелинейные исходы заболеваний в случае инфекционных болезней являются важными соображениями для эпиднадзора за заболеваниями и разработки политики общественного здравоохранения.
В заключение следует отметить, что динамика инфекционных заболеваний имеет важный компонент - совместное инфицирование или совместное присутствие микроорганизмов (потенциальных патогенов). Степень и характер этой обусловленности и лежащие в ее основе механизмы остаются в значительной степени неизученными. Мультиомические подходы могут предоставить соответствующие инструменты и методы для более четкого понимания и выяснения роли и значения сопутствующих инфекций в модуляции исходов инфекционных заболеваний.