Ученые смогли проследить, как микроорганизм с множественной лекарственной устойчивостью способен развиваться и широко распространяться у больных муковисцидозом.
По словам исследователей, их результаты подчеркивают необходимость немедленного лечения пациентов с инфекцией Mycobacterium abscessus, что противоречит существующей медицинской практике.
Примерно один из 2500 детей в Великобритании рождается с муковисцидозом - наследственным заболеванием, имеющим тенденцию к сокращению продолжительности жизни пациентов. В последние годы M. abscessus с множественной лекарственной устойчивостью, стал представлять глобальную угрозу для людей с муковисцидозом и другими заболеваниями легких. Эта бактерия может вызвать тяжелую пневмонию, приводящую к ускоренному воспалительному поражению легких, и может препятствовать безопасной трансплантации легких. Кроме того, эту инфекцию чрезвычайно трудно лечить - успешным бывает менее одного случая из трех.
В исследовании, опубликованном недавно в Science, специалисты Кембриджского университета изучили данные о полных геномах 1 173 клинических образцов M. abscessus, взятых у 526 пациентов, чтобы понять, как эволюционировал и продолжает эволюционировать этот микроорганизм. Образцы были получены из клиник по лечению муковисцидоза в Великобритании, а также из центров в Европе, США и Австралии.
Ученые обнаружили два ключевых процесса, которые играют важную роль в эволюции этого микроорганизма. Первый известен как горизонтальный перенос генов - процесс, в ходе которого бактерии забирают гены или участки ДНК у других бактерий в окружающей среде. В отличие от классической эволюции, которая является медленным, постепенным процессом, горизонтальный перенос генов может привести к большим скачкам в эволюции патогена, потенциально позволяя ему внезапно стать гораздо более вирулентным.
Второй процесс находится в рамках эволюции внутри организма хозяина. Несколько вариантов бактерий могут развиваться параллельно - и чем дольше существует инфекция, тем больше у них возможностей для эволюции, при этом в конечном итоге побеждают наиболее приспособленные варианты. Аналогичные явления наблюдались и в эволюции новых вариантов SARS-CoV-2 у иммунокомпрометированных пациентов.
Профессор Андрес Флото, старший автор исследования отмечает: "В итоге мы получаем параллельную эволюцию в разных частях легких человека. Это дает бактериям возможность многократно "бросать кости", пока они не найдут наиболее удачные мутации. В итоге получается очень эффективный способ адаптации к хозяину и повышения вирулентности".
"Это говорит о том, что, возможно, вам необходимо лечить инфекцию сразу же после ее выявления. В настоящее время, поскольку препараты могут вызывать неприятные побочные эффекты и должны применяться в течение длительного периода времени - часто до 18 месяцев - врачи обычно ждут, пока бактерии вызовут заболевание, прежде чем лечить инфекцию. Но это дает бактерии достаточно времени для постоянного развития, что потенциально усложняет лечение".
Флото и его коллеги ранее выступали за постоянное наблюдение за пациентами с муковисцидозом с целью выявления бессимптомной инфекции. Для этого пациенты должны три или четыре раза в год сдавать образцы мокроты, чтобы проверить наличие инфекции M. abscessus. Такое наблюдение проводится регулярно во многих центрах в Великобритании.
Используя математические модели, исследователи смогли проследить эволюцию этого организма у одного человека и воссоздать его траекторию, отыскивая ключевые мутации в каждом микроорганизме в каждой части легкого. Сравнивая образцы от нескольких пациентов, они смогли определить ключевой набор генов, который позволил этой бактерии превратиться в потенциально смертельно опасный патоген. Эти адаптации могут происходить очень быстро, но группа обнаружила, что их способность передаваться между пациентами была ограничена: парадоксально, но те мутации, которые позволили организму стать более успешным патогеном внутри пациента, также снизили его способность выживать на внешних поверхностях и в воздухе - ключевые механизмы, с помощью которых он, как считается, передается между людьми.
Потенциально одним из наиболее важных генетических изменений, наблюдаемых исследователями, было то, что M. abscessus стал устойчив к оксиду азота, соединению, естественно вырабатываемому иммунной системой человека. В ближайшее время коллектив начнет клинические испытания, направленные на повышение уровня оксида азота в легких пациентов с помощью вдыхаемого оксида азота, что, как они надеются, станет новым методом лечения этой разрушительной инфекции.
Изучение ДНК, взятой из образцов пациентов, также важно для понимания путей передачи инфекции. Такие методы регулярно используются в больницах Кембриджа для составления карты распространения таких инфекций, как MRSA и C. difficile, а в последнее время - SARS-CoV-2. Изучение распространения M. abscessus помогло разработать проект нового здания Королевской больницы Папворт, открытого в 2019 году, в котором установлена самая современная система вентиляции для предотвращения передачи инфекции. Недавно группа опубликовала исследование, показывающее, что эта система вентиляции очень эффективно снижает количество бактерий в воздухе.
Профессор Джулиан Пархилл, старший автор исследования, добавляет: "M. abscessus может быть очень сложной инфекцией для лечения и очень опасной для людей, живущих с муковисцидозом, но мы надеемся, что результаты нашего исследования помогут нам снизить риск передачи инфекции, остановить дальнейшую эволюцию патогена и, возможно, предотвратить появление новых патогенных вариантов".
Группа также использовала свои разработки для изучения эволюции M. tuberculosis. По аналогии с M. abscessus, M. tuberculosis, вероятно, начал свою жизнь как экологический организм, приобрел гены путем горизонтального переноса, которые сделали определенные клоны более вирулентными, а затем эволюционировал в ходе многочисленных раундов эволюции внутри хозяина. В то время как M. abscessus в настоящее время остановлен на этой эволюционной точке, M. tuberculosis эволюционировал дальше, и теперь имеет возможность распространяться непосредственно от одного человека к другому.
Люси Аллен, директор по исследованиям в Cystic Fibrosis Trust, говорит: "Это захватывающее исследование дает реальную надежду на лучшие способы лечения устойчивых к лекарственным препаратам легочных инфекций".
Josephine M. Bryant et al. Поэтапная патогенная эволюция Mycobacterium abscessus (аннотация).
Почти все виды микобактерий являются свободно живущими в окружающей среде сапрофитами. Некоторые из них, такие как Mycobacterium tuberculosis, эволюционировали, чтобы вызывать трансмиссивные инфекции человека и в конечном итоге стать облигатными патогенами человека. Недавнее появление и глобальное распространение вирулентных клонов экологической нетуберкулезной микобактерии M. abscessus предоставило уникальную возможность изучить патогенную эволюцию микобактерий.
M. abscessus, мультирезистентный вид нетуберкулезных микобактерий, недавно стал представлять серьезную угрозу для людей с муковисцидозом (МВ) и другими хроническими заболеваниями легких. Уровень инфицирования в сообществе больных МВ растет во всем мире, что частично обусловлено непрямой передачей M. abscessus от человека к человеку.
В настоящее время более 70% инфекций у больных МВ вызываются генетически кластеризованными (и, следовательно, передающимися) изолятами, большинство из которых являются представителями трех доминирующих циркулирующих клонов (ДЦК), появившихся за последние 50 лет и распространившихся по всему миру. Эти кластеризованные изоляты более вирулентны при тестировании in vitro и in vivo и приводят к худшим клиническим исходам, что позволяет предположить, что они эволюционируют из экологических сапрофитов в облигатные патогены легких. Мы предположили, что функциональный геномный анализ M. abscessus может выявить важные обобщающие шаги на этой эволюционной траектории и определить потенциальные меры по смягчению этого процесса для этого и других новых микобактериальных патогенов.
Результаты
Вначале мы попытались понять, как могли возникнуть ДЦК. Используя графический пангеномный анализ, мы обнаружили, что горизонтальный перенос генов - в частности, перенос генов глобальных транскрипционных регуляторов - может служить важным механизмом для создания большого фенотипического разнообразия в экологических изолятах M. abscessus, что, следовательно, позволит сальтационной эволюции повысить инфекционность для людей. Этот процесс может быть обобщен на все виды микобактерий, где события, связанные с приобретением или потерей генов, были связаны с патогенной эволюцией вирулентных клонов у нескольких видов, включая кластер 1a у M. avium, клон A у M. canettii и монофилетический комплекс M. tuberculosis от M. canettii-подобного предка.
Далее мы изучили, может ли продолжающаяся адаптация инфицирующих клонов M. abscessus способствовать дальнейшему развитию патогенности. Мы реконструировали эволюционные траектории отдельных субклонов M. abscessus у хронически инфицированных пациентов, определив конвергентную аллопатрическую эволюцию внутри и между особями как ключевой фактор патогенной адаптации. В частности, повторяющиеся мутации в небольшом наборе генов из одной функциональной сети, вероятно, определяют повышение выживаемости макрофагов и вирулентности in vivo.
Для многих адаптивных мутаций мы наблюдали снижение приспособленности к трансмиссии. Для двух часто мутировавших генов (phoR и локус GPL) нокауты показали ухудшенное выживание на фомитах. Эти результаты свидетельствуют о том, что эволюция внутри хозяина ограничена, а для передачи необходим экологический посредник.
Заключение
Наши результаты указывают на обобщающую модель эволюции патогенных микобактерий. Первоначально горизонтальное приобретение генов клонами из окружающей среды (особенно генов с глобальными транскрипционными эффектами) стимулирует сальтационную эволюцию и повышает вирулентность, что приводит к появлению предков доминирующих циркулирующих клонов M. abscessus и стимулирует появление вирулентных клонов у других видов микобактерий.
Далее, внутрихозяинная адаптация во время хронической инфекции приводит к увеличению внутриклеточного выживания в макрофагах и воспалительному поражению легких. Однако патогенная эволюция сдерживается, пока M. abscessus передается через экологических посредников, поскольку наиболее высокоадаптированные штаммы теряют способность к передаче инфекции из-за снижения выживаемости фомитов.
В конечном итоге, мы прогнозируем, что возможности прямой передачи новых микобактерий (потенциально через увеличение плотности населения и/или восприимчивости хозяина) обеспечат неограниченную, ускоренную эволюцию в облигатный патоген человека (как это произошло с M. tuberculosis несколько тысяч лет назад). Наши результаты показывают, как основные мероприятия, такие как раннее лечение и контроль перекрестных инфекций, могут ограничить существующие патогены и предотвратить появление новых.
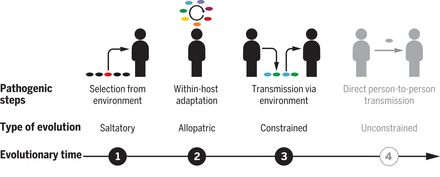
Этапы эволюции патогенных микобактерий.
(1) Горизонтальное приобретение генов клонами из окружающей среды стимулирует сальтационную эволюцию и приводит к появлению предков доминирующих циркулирующих клонов M. abscessus (и вирулентных клонов других видов микобактерий).
(2) Аллопатрическая внутрихозяинная адаптация во время хронической инфекции приводит к увеличению внутриклеточного выживания в макрофагах и воспалительному поражению легких.
(3) Эволюция сдерживается, пока M. abscessus передается через экологических посредников, поскольку наиболее высокоадаптированные штаммы теряют способность к передаче из-за снижения выживаемости фомитов.
(4) Возможности прямой передачи новых микобактерий (потенциально за счет увеличения плотности популяции и/или восприимчивости хозяина) обеспечивают неограниченную, ускоренную эволюцию (как это произошло с M. tuberculosis).