Влияние вирусов на нашу повседневную жизнь трудно игнорировать.
Помимо присущего некоторым вирусам потенциала вызывать заболевания, другие (посредством мутации генома и манипулирования физиологией хозяина) могут непреднамеренно мобилизовать гены, которые могут быть полезны для хозяина, и даже придать организму новые свойства. Чтобы полностью понять, как вирусы сформировали нас, мы должны не только изучать современные микроорганизмы, но и исследовать вирусные "ископаемые" внутри наших собственных геномов.
Приобретение генов у вирусов
Вирусы вносят большой вклад в генетические изменения, особенно когда они интегрируются в геном клетки. Палеовирусология изучает геномные следы исторических событий вирусной интеграции у современных животных.
Например, считается, что вирусы заложили генетическую основу плацентарных млекопитающих путем многочисленных инсерций. У млекопитающих, включая человека, ген синцитина обеспечивает слияние эмбриона с плацентой. Считается, что он происходит от вируса HERV-W, который использует родственный ген для соединения своей оболочки с клеткой-хозяином. О том, как давно произошла инфекция, можно судить, сравнив сиквенсы современных вирусных генов с эндогенными вирусными элементами (EVE) и определив наличие преждевременных стоп-кодонов. Они указывают на то, что ДНК успела накопить мутации и что ген может быть все еще активен.
Геномы хозяев часто содержат многочисленные и разнообразные EVE. Предполагается, что эндогенные ретровирусы человека занимают 9% генома, еще 30% работают в координации с ретровирусными элементами, а еще 50% имеют неизвестную функцию. У одного исследованного вида ракообразных 5 семейств вирусов были представлены в качестве EVEs, а из 54 идентифицированных участков 30, по всей видимости, были получены в результате недавнего приобретения или текущей циркулирующей инфекции. Остальные были определены как более старые, поскольку содержали нонсенс-мутации.
С помощью геномных методов бывает трудно отличить современные, активные инфекции от недавних событий интеграции, поскольку мутации не успели накопиться, чтобы показать дивергенцию, что, в свою очередь, затрудняет определение времени. Кроме того, геном сам по себе не показывает, что происходит внутри клетки. Тем не менее, инвентаризация EVE, присутствующих в геноме, все еще представляет ценность как способ начать понимать вклад вирусов в развитие вида.
Горизонтальный перенос генов расширяет генетический инструментарий клетки. В микробном мире вирусы участвуют в некоторых событиях горизонтального переноса генов и в настоящее время считаются основным резервуаром генов резистентности к антибиотикам (ARG). Экологические ниши, в которых обитают вирусы, содержащие ARG, включают сточные воды, органически удобренную почву и больничные стационары. Хотя большая часть переноса ARG происходит клеточно-опосредованным путем, небольшая, но важная часть, по-видимому, объясняется вирусной передачей.
Вирусная передача новых генетических элементов происходит через ошибки при упаковке генома. Когда вирус случайно упаковывает ДНК хозяина в вирусный капсид с последующим лизогенным инфицированием новой клетки, ДНК предыдущего хозяина может быть перенесена. Если эта ДНК включает полноценный ген, например, ген резистентности к антибиотикам, новый хозяин может получить эту функцию.
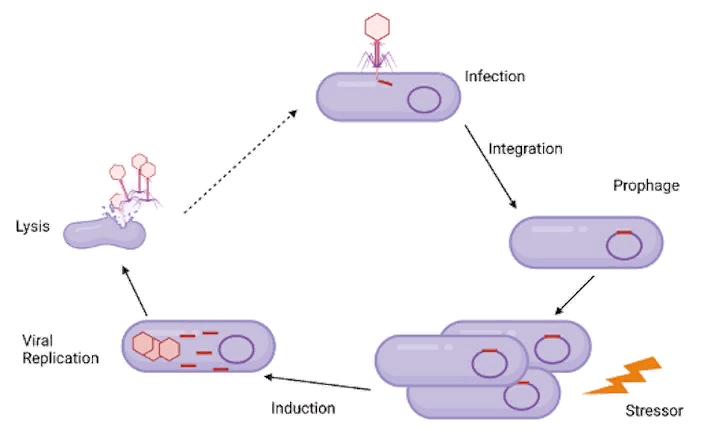
Лизогенный цикл вирусной репликации. ДНК фага интегрируется в геном хозяина, затем, после стимула из окружающей среды, реактивируется и реплицируется, как при литической инфекции. Рис.: Elise Phillips.
Капсиды вирусов действуют как оболочка для ДНК, что помогает удерживать ARG в окружающей среде, позволяя им распространяться через микробные популяции более эффективно, чем голая ДНК. Эта проблема усугубляется высокой нагрузкой антибиотиков и плотными популяциями хозяев, характерными для промышленного сельского хозяйства, что видно по относительно большой доле ARG-содержащих свободных вирусов, выделенных из метагеномов сточных вод свиноводческих хозяйств. Будущие планы по рациональному использованию антибиотиков выиграют, если будут включать способы уменьшения вирусного резервуара генов резистентности к антибиотикам.
Вклад вирусов в ядро
Прокариоты часто определяются, по крайней мере, условно, по отсутствию ядра. В то время как внутренняя организация бактерий и архей становится все более понятной, вопрос о ядерном происхождении эукариотических клеток остается неизвестным. Одна из интригующих, если не сказать спорных, гипотез происхождения ядер известна как "вирусный эукариогенез". Согласно этой идее, ядро возникло в результате вирусной инфекции древних, вероятно архейских, клеток.
Первые доказательства этой идеи были получены из сходства между ядерными признаками эукариот и признаками, индуцированными поксвирусами. Поксвирус кодирует ДНК-полимеразу, которая очень похожа на эукариотическую ДНК-полимеразу А и реплицируется внутри связанного с мембраной "мини-ядра". Определяющей особенностью ядра является разделение транскрипции и трансляции, которые происходят одновременно у бактерий и архей. Древние клетки с доядерными структурами должны были бы иметь стратегии, обеспечивающие это разделение. Поксвирус осуществляет кэппинг (перемещение к одному полюсу клетки) мРНК, добавление модифицированного гуанозина к транскриптам мРНК, что обеспечивает ядерный экспорт и трансляцию в эукариотах и является одним из решений для необходимой развязки, описанной выше. Хотя эти сходства не означают напрямую, что эукариоты развились в результате инфицирования поксвирусами, они указывают на общего предка для этих генов и предполагают вирусный вклад в эволюцию ядра.
Дальнейшими доказательствами, подтверждающими вклад вирусов в ядро, являются многочисленные вирусные инфекции, в результате которых образуются новые клеточные сегменты. Вирусное использование и манипулирование механизмами хозяина для репликации является отличительной чертой активной инфекции, в некоторых случаях вызывая значительное ремоделирование клеточной архитектуры хозяина (мембран и белков) для создания новых структур. Многие современные эукариотические и прокариотические вирусы создают субклеточные сегменты для своей репликации. Например, вирус Pseudomonas 201 создает протеиновый отсек, чтобы отделить репликацию ДНК и транскрипцию от трансляции.
Между тем, Medusavirus, заражающий эукаротическую амебу Acanthamoeba, захватывает ядро хозяина и использует сегментирование для отделения процесса репликации от упаковки вириона. Сегментирование попеременно рассматривается как способ защиты механизмов репликации от вирусных атак и, наоборот, как способ защиты вирусной ДНК от механизмов CRISPR, которые действуют в качестве бактериального иммунитета против вирусной инфекции. В свете множества возможных стратегий вирусного эукариогенеза кажется вероятным, что вирусы сыграли свою роль в эволюции ядра.
Вирусы формировали наш клеточный состав еще до диверсификации трех доменов жизни, предоставляя клеткам новый генетический потенциал. Несмотря на отсутствие ископаемых останков первых ядерных клеток, современные инфекции указывают на роль вирусов в их эволюции, а интеграция вирусов в геномы хозяев позволила организмам из всех доменов жизни получить новые функции и активно формировать окружающий нас мир.