Все микроорганизмы в микробиоме несут свои гены и экспрессируют свои белки, некоторые из которых высвобождаются в организме и оказывают на него определенное воздействие.
Исследователи охарактеризовали генетические сигнатуры бактерий и установили их связь с несколькими заболеваниями, включая воспалительные заболевания кишечника, рак толстой кишки, ишемическую болезнь сердца, цирроз печени и диабет второго типа. Результаты исследования опубликованы в Nature Communications, и они могут быть полезны при разработке диагностических тестов, которые предсказывают или идентифицируют заболевания.
Эта работа показала, что три из этих видов заболеваний: воспалительные заболевания кишечника, ишемическая болезнь сердца и цирроз печени - имеют много общих генов в своих сигнатурах. Таким образом, люди, которые несут эти бактериальные гены в своем кишечном микробиоме, вероятно, более склонны к одному или нескольким из этих заболеваний. Однако сигнатура диабета 2 типа была не похожа на другие.
По мнению ученых, данное исследование является значительным шагом вперед на пути к использованию образцов кала в качестве инструментов диагностики многочисленных заболеваний. "Это открывает возможности для разработки тестов, использующих индикаторы здоровья пациента, основанные на генах, для выявления различных заболеваний", - сказал первый автор исследования Брейден Тирни. "Мы выявили генетические маркеры, которые, по нашему мнению, в конечном итоге могут привести к созданию тестов или всего одного теста для выявления ассоциаций с рядом заболеваний".
Еще многое предстоит узнать о том, как именно эти гены связаны с этими расстройствами, и являются ли они причиной или просто частью патологического состояния.
"Наше исследование подчеркивает ценность науки о данных (data science) для изучения сложного взаимодействия между микробами и человеком", - говорит соавтор исследования Чираг Патель.
В исследовании ученые оценили данные микробиома 2500 пациентов из 13 групп. Вычислительные методы смоделировали связи между семью заболеваниями, а также бактериальными метаболическими путями и генами. Работа показала, что бактериальные гены, а не семейства бактерий, являются лучшими индикаторами того или иного заболевания. Дополнительные исследования показали, что бактерия Solobacterium moorei и рак толстой кишки не показывают устойчивой связи, что противоречит предыдущим работам. Однако определенные гены, носителями которых является один из штаммов S. moorei, были связаны с раком толстой кишки. Это может свидетельствовать о том, что бактериальные гены являются лучшими биомаркерами заболеваний, чем существующие подходы, которые рассматривают семейства бактерий.
Точные связи между заболеваниями и бактериальными генами сделают диагностические тесты лучше, отметил Патель. Например, при колоректальном раке выявление конкретных штаммов S. moorei будет более полезным.
Были обнаружены лишь слабые связи между микробиомом кишечника и двумя другими заболеваниями: воспалением уха и аденомами, поэтому микробиом, вероятно, не связан с их развитием и не будет полезен в диагностике, связанной с этими расстройствами.
"Конечная цель вычислительной науки - генерировать гипотезы из огромного массива данных", - отметил Тирни. "Наша работа показывает, что это можно сделать, и открывает столько новых путей для исследований и изучения, что мы ограничены только временем, людьми и ресурсами, необходимыми для проведения этих исследований".
Braden T. Tierney et al. Метагеномная архитектура при различных заболеваниях позволяет получить микробиомные диагностические индикаторы высокого разрешения (аннотация).
Мы предлагаем "архитектуры" микробиомных заболеваний: связывая >1 миллиона микробных характеристик (виды, пути и гены) с 7 фенотипами хозяина из 13 когорт с помощью системы, разработанной для выявления ассоциаций, которые надежны при выборе аналитической модели. В данном исследовании мы оцениваем консервативность и гетерогенность ассоциаций между микробиомами и заболеваниями, используя анализ на уровне генов для выявления специфических для штаммов, перекрестных заболеваний, положительных и отрицательных ассоциаций. Так, мы обнаружили, что ишемическая болезнь сердца, воспалительные заболевания кишечника и цирроз печени имеют общие генные сигнатуры, приписываемые роду Streptococcus.
Диабет 2 типа, для сравнения, имеет особую метагеномную сигнатуру, не связанную ни с одним конкретным видом или родом. Кроме того, мы обнаружили, что на видовом уровне ранее заявленная связь между Solobacterium moorei и колоректальным раком не была выявлена в разных моделях, однако наш анализ на генном уровне выявил группу надежных, специфических для конкретного штамма генных ассоциаций.
Кроме того, мы подтвердили наши выводы относительно колоректального рака и воспалительных заболеваний кишечника в независимых когортах и выявили, что признаки, обратно связанные с заболеванием, как правило, менее воспроизводимы, чем признаки, усиленные заболеванием.
В целом, наша работа является не только шагом к созданию основанных на генах диагностических показателей микробиома по всем заболеваниям, но и освещает нюансы генетической архитектуры микробиома человека, включая противоречия между ассоциациями на уровне генов и видов.
Почти половина взрослого населения США страдает гипертонией - заболеванием, повышающим риск развития сердечно-сосудистых заболеваний и инсульта, которые являются основными причинами смерти в США.
Появились новые данные о том, что нарушение микробиоты кишечника, известное как дисбиоз кишечника, может оказывать неблагоприятное воздействие на кровяное давление.
"Предыдущие исследования нашей лаборатории показали, что состав микробиоты кишечника в животных моделях гипертонии, таких как модель SHRSP (спонтанная гипертония крыс подверженных инсульту), отличается от такового у животных с нормальным кровяным давлением", - говорит соавтор исследования, опубликованного в Circulation Research Дэвид Дурган. Исследователи также показали, что пересадка дисбиотической микробиоты кишечника от гипертонического животного к нормотензивному приводит к тому, что у реципиента развивается высокое кровяное давление.
"Этот результат подсказал нам, что дисбиоз кишечника является не просто следствием гипертонии, а фактически участвует в ее возникновении", - отметил Дурган. "Эта предпосылка привела к нынешнему исследованию, в котором мы попытались ответить на два вопроса. Во-первых, можем ли мы управлять дисбиотической микробиотой, чтобы предотвратить или облегчить гипертонию? Во-вторых, как микробы кишечника влияют на кровяное давление животных?".
Чтобы ответить на первый вопрос, Дурган и его коллеги опирались на результаты предыдущих исследований, показавших, что голодание является одним из основных факторов, определяющих состав микробиоты кишечника и способствующих благоприятному воздействию на сердечно-сосудистую систему. Однако в этих исследованиях не было доказательств связи между микробиотой и кровяным давлением.
Работая с моделью спонтанной гипертензии SHRSP и нормальными крысами, исследователи сформировали две группы. В одной группе были SHRSP и нормальные крысы, которых кормили через день, а в другой, контрольной, были SHRSP и нормальные крысы с неограниченным доступом к пище.
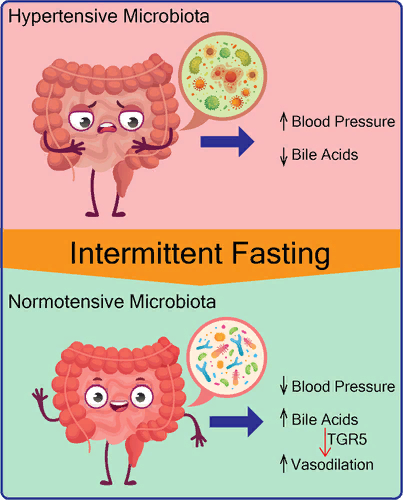
Через девять недель после начала эксперимента исследователи заметили, что, как и ожидалось, у крыс из группы SHRSP было более высокое кровяное давление по сравнению с обычными контрольными крысами. Интересно, что в группе, которая голодала каждый второй день, у крыс SHRSP значительно снизилось кровяное давление по сравнению с крысами SHRSP, которые не голодали. "Далее мы исследовали, участвует ли микробиота в снижении кровяного давления, которое мы наблюдали у крыс SHRSP, которые постились", - рассказывает Дурган.
Они пересадили микробиоту крыс, которые постились или питались без ограничений, крысам без собственной микробиоты и были рады увидеть, что у безмикробных крыс, получавших микробиоту нормально питавшихся крыс SHRSP, кровяное давление было выше, чем у безмикробных крыс, получавших микробиоту от нормальных контрольных крыс, как и у их соответствующих доноров микробиоты. "Особенно интересно было видеть, что у безмикробных крыс, получавших микробиоту от постящихся крыс SHRSP, артериальное давление было значительно ниже, чем у крыс, получавших микробиоту от контрольных крыс SHRSP", - сказал Дурган.
"Эти результаты показали, что изменения в микробиоте, вызванные голоданием, были достаточными для того, чтобы обеспечить понижающий артериальное давление эффект прерывистого голодания".
Далее группа приступила к исследованию второго вопроса своего исследования. Как микробиота кишечника регулирует кровяное давление?
"Мы сделали анализ всего генома микробиоты, а также метаболомический анализ плазмы и содержимого просвета желудочно-кишечного тракта. Среди изменений, которые мы наблюдали, изменения в продуктах метаболизма желчных кислот выделялись как потенциальные медиаторы регуляции артериального давления", - сообщил Дурган.
Группа обнаружила, что у гипертензивных животных SHRSP, которых кормили в обычном режиме, содержание желчных кислот в крови было ниже, чем у нормотензивных животных. С другой стороны, у животных SHRSP, которые питались по прерывистому графику, желчных кислот в крови было больше. "Подтверждая этот вывод, мы обнаружили, что увеличение холевой кислоты, основной желчной кислоты, также значительно снижало кровяное давление в модели гипертонии SHRSP", - отметил Дурган.
В целом, исследование впервые показывает, что прерывистое голодание может быть полезным с точки зрения снижения гипертонии путем изменения состава микробиоты кишечника в животной модели. В работе также представлены доказательства того, что дисбиоз кишечника способствует развитию гипертонии, изменяя сигнализацию желчных кислот.
"Это исследование важно для понимания того, что голодание может оказывать свое влияние на организм хозяина через манипуляции с микробиотой", - сказал Дурган.
"Это привлекательная идея, потому что потенциально она может иметь клиническое применение. Многие бактерии микробиоты кишечника участвуют в производстве соединений, которые, как было показано, оказывают благоприятное воздействие, попадая в кровь и участвуя в регуляции физиологии хозяина. График голодания может однажды помочь регулировать активность микробных популяций кишечника, чтобы естественным образом обеспечить пользу для здоровья".
Huanan Shi et al. Реструктуризация микробиоты кишечника с помощью прерывистого голодания снижает артериальное давление (аннотация).
В последние годы было продемонстрировано, что патологическое изменение микробиоты кишечника, называемое дисбиозом кишечника, может быть фактором, лежащим в основе развития гипертонии. Предотвращение этого дисбиоза может ослабить или устранить гипертонию. Трансляционные механизмы профилактики дисбиоза кишечника, а также понимание механизмов, связывающих дисбиоз кишечника с гипертонией, отсутствуют.
В первую очередь мы изучили эффективность прерывистого голодания (ПГ) в изменении микробиоты кишечника и снижении артериального давления (АД). Затем мы использовали мультиомический подход для изучения влияющих на микробы метаболитов, которые могут служить связующим звеном между микробиотой кишечника и регуляцией АД.
Мы продемонстрировали, что ПГ значительно изменило состав микробиоты кишечника, метаболом печени и плазмы крови и предотвратило развитие гипертонии у спонтанно гипертензивных крыс, подверженных инсульту. Благоприятное воздействие ПГ было доказано в результате изменения микробиоты кишечника с помощью исследований по трансплантациям. У безмикробных крыс, получавших микробиоту от спонтанно гипертензивных крыс, подверженных инсульту, значительно снизилось АД по сравнению с безмикробными крысами, получавшими микробиоту от спонтанно гипертензивных крыс, подверженных инсульту. С помощью цельногеномного анализа микробиоты и метаболомики аналитов печени и плазмы мы определили метаболизм желчных кислот как потенциальный медиатор в регуляции АД. Наконец, мы показали, что добавление холевой кислоты или активация рецептора желчных кислот, связанного с белком G (TGR5), значительно снижает АД у крыс, подверженных спонтанному гипертоническому инсульту.
Эти исследования показывают, что эффект снижения АД, оказываемый ПГ, обусловлен манипуляциями с микробиотой кишечника и метаболомом, и указывают на нарушение сигнализации желчных кислот как на новые механизмы, с помощью которых дисбиоз кишечника способствует развитию гипертонии.