Рак желудка (РЖ) - опасное заболевание, в 2020 году он занял 3-е место среди причин смертности людей во всем мире и является пятым наиболее часто диагностируемым раком.
РЖ обычно развивается в несколько этапов, начиная с атрофического гастрита, который прогрессирует в кишечную метаплазию, и в конечном итоге проявляясь в виде РЖ. Было показано, что взаимодействие хозяина и микробиоты, например, микробные инфекции желудка и иммунные факторы хозяина, способствуют развитию опухоли в желудочно-кишечном тракте (Dicken et al., 2005). Однако этиология и патогенез, а также их трансляционная роль в патогенезе РЖ нуждаются в дальнейших исследованиях для эффективного выяснения.
Последние данные указывают на участие микробиома желудка в возникновении и прогрессировании заболевания. Желудок считался "враждебным местом" для роста бактерий, поскольку условия в нем были неподходящими для их роста. С 1980-х годов было установлено, что Helicobacter pylori является наиболее распространенным микроорганизмом, вызывающим заболевания желудочно-кишечного тракта (ЖКТ). Однако среди всех пациентов, инфицированных H. pylori, только у 1-3% в конечном итоге развивается РЖ (Wang et al., 2014), и прогрессирование рака все еще может быть обнаружено после эрадикации H. pylori с помощью фармакологического лечения, что указывает на то, что не только H. pylori, но и другие микробы могут паразитировать в желудке и играть определенную роль в возникновении и прогрессировании РЖ.
Развитие технологий высокопроизводительного секвенирования позволило обнаружить изменения микробного состава и характеристик желудка на стадиях здоровья и болезни. В одном из исследований были получены доказательства того, что бактерии полости рта могут быть обнаружены в образцах из ЖКТ (Chen et al., 2019), а виды Streptococcus, Prevotella, Neisseria, Haemophilus и Porphyromonas были признаны наиболее доминирующими бактериями в ЖКТ (Bik et al., 2006). Возникающие или вновь появляющиеся грибки становятся угрозой здоровью, тесно связанной с иммунной модуляцией хозяина (Lockhart and Guarner, 2019). Недавние исследования подтвердили изменения видового состава грибов в ткани аденомы толстой кишки (Coker et al., 2019), при болезни Крона (Liguori et al., 2016) и у пациентов с язвенным колитом (Sokol et al., 2017), что открывает возможности для выявления новых взаимодействий микробиома хозяина и грибов. Однако существует относительно мало исследований, направленных на лучшее понимание функциональной роли грибковой микробиоты желудка при РЖ, особенно с точки зрения их потенциальной диагностической ценности в скрининге РЖ.
В данном исследовании, посредством комплексного анализа грибковых микробиомов при РЖ, мы стремились выделить и понять различные компоненты грибкового микробиома желудка; обозначить клиническую значимость конкретных грибов, которые могут иметь решающее значение для патогенеза и диагностики РЖ, что может быть использовано для разработки лучших стратегий профилактики и лечения РЖ. Насколько нам известно, данное исследование является первым в своем роде, которое предоставляет подробные доказательства взаимодействия между иммунными факторами хозяина и грибковым микробиомом, особенно в отношении потенциальной диагностической значимости грибков при РЖ.
Все чаще признается, что грибковый микробиом, включающий роды Fusarium и Aspergillus, а также некоторые другие роды (например, Alternaria и Mucor), составляющие группу новых патогенов у человека, играет важную роль в этиологии рака (Perlin et al., 2017). Взаимодействие грибковой микробиоты с хозяином стало решающим фактором в изменении физиологии хозяина и связанных с микробиотой желудка заболеваний. В этой статье мы показываем, что при РЖ сохраняются специфические для заболевания изменения в грибковом микробиоме. Впервые мы раскрываем иммунологический процесс патогенеза РЖ и влияние грибов на пациентов с РЖ с точки зрения взаимодействия хозяина и микробиоты путем одновременного изучения грибковых и местных иммунных реакций.
С развитием технологий секвенирования нового поколения было доказано, что изменения в таксонах грибов повсеместно влияют на развитие иммунного ответа хозяина, а также на возникновение и прогрессирование некоторых видов рака (Sokol et al., 2017; Aykut et al., 2019; Coker et al., 2019). Поэтому не менее важно изучить взаимосвязь между нарушением жизнедеятельности грибков и точным механизмом, лежащим в основе развития РЖ. В данном исследовании мы непосредственно профилировали специфический для заболевания грибковый микробиом в тканях ЖКТ, что часто является единственной стратегией для выявления специфических дисрегуляторных состояний, связанных с микросредой пораженной ткани.
Было обнаружено снижение биоразнообразия как в образцах РЖ, изменение состава с уменьшением Rozellomycota и увеличением Ascomycota и Basidiomycota по сравнению с группой здоровых контролей (ЗК). Кроме того, соотношение Basidiomycota и Ascomycota и доля условно-патогенных грибов, т.е. Malassezia и Trichosporon, что отражает грибковый дисбиоз, были выше в группах РЖ, чем ЗК. Мы также обнаружили, что желудочные грибы дифференцировали РЖ и здоровый контроль на две значительно отличающиеся группы, что указывает на уникальные грибковые профили. Zhong et al. (2021) обнаружили, что обилие Fusicolla acetilerea, Arcopilus aureus и Fusicolla aquaeductuum было относительно выше в тканях РЖ, чем в соседних нераковых тканях, но различий между тканями РЖ и ЗК не наблюдалось, что объясняется тесной анатомической близостью и/или различными популяционными характеристиками в данном исследовании.
Мы также выявили специфические для РЖ изменения в составе грибов, включая девять классов, 11 порядков и 19 семейств, такие как обогащение Cutaneotrichosporon, Apiotrichum и Malassezia из филума Basidiomycota и исчезновение Lecanactis, Apodus и Exophiala из филума Ascomycota, что предполагает, что они могут играть роль в патогенезе РЖ и требует дальнейшего изучения. Предыдущие исследования показали, что Malassezia обычно обитает на коже человека и обладает способностью колонизировать ЖКТ (Richard et al., 2015; Sokol et al., 2017), а также может взаимодействовать с клетками, участвующими в иммунных функциях, и вызывать выработку различных цитокинов и некоторых секретируемых ферментов, что в конечном итоге приводит к канцерогенезу (Gaitanis et al., 2012).
Интересно, что наши результаты показали очевидную даунрегуляцию Rhodotorula при РЖ, что стало возможностью инфицирования патогенами восприимчивых пациентов, особенно при раковых заболеваниях и СПИДе (Miceli et al., 2011). Примечательно, что мы выявили некоторые ранее не описанные грибы, ассоциированные с РЖ, что может быть связано с различными переменными, такими как возраст, пол, диета и методы секвенирования, которые могут влиять на состав микробиома. Мы также оценили диагностическую ценность 10 наиболее распространенных родов, и все они показали многообещающие результаты. Эти наблюдения дают возможность использовать отличительные грибы для выявления и мониторинга прогрессирования РЖ. Несомненно, необходимы дальнейшие исследования с большим размером выборки, большим количеством клинических центров и более строгими критериями отбора. Для раскрытия механизма между дисрегуляторными грибками и РЖ рекомендуется проведение дальнейших эпидемиологических исследований и биофункциональных тестов.
Аберрантная продукция цитокинов с функцией регуляции ангиогенеза, роста, прогрессии и метастазирования опухоли ранее изучалась различными методами (Lee et al., 2014; Park et al., 2019). Провоспалительные хемокины CXCL9, CXCL10 и CXCL11 были сверхэкспрессированы в 2 раза при РЖ по сравнению с нормальными тканями (Lee et al., 2014), что согласуется с нашими данными. Было подтверждено, что IL-10 высоко экспрессируется при различных типах рака, включая рак яичников (Ahmad et al., 2018), лимфому (Gupta et al., 2012), рак простаты (Lin and Zhang, 2017) и РЖ (Fortis et al., 1996), который может снижать уровень воспалительных цитокинов IL-6 и IL-8.
В нашем исследовании уровни мРНК IL-6 и IL-8 были снижены в группе РЖ, вероятно, из-за повышенного уровня IL-10 в локальной области опухоли. Интересно, что ассоциативный анализ различных грибов в группах ЗК и РЖ показал, что иммунные ответы были сильно взаимосвязаны с вариациями родов. CXCL9, CXCL10, CXCL11, TNF-α и IL-10 положительно коррелировали с Apiotrichum, Cutaneotrichosporon, Simplicillium и Sarocladium, а пониженные IL-4, IL-6, IL-8, CCL17 и YM-1 показали положительную связь с Cystobasidium, Apodus, Lecanactis, Rhizopus, Rhodotorula и Exophiala. Все эти результаты создают основу для дальнейшего изучения механизмов различных грибковых инфекций и РЖ.
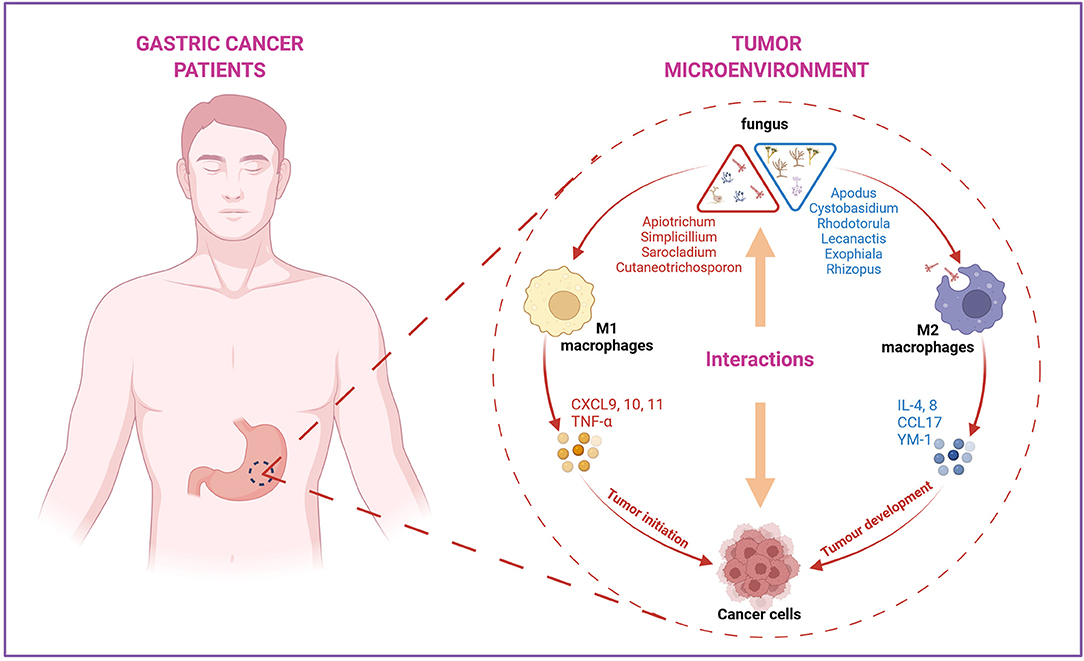
Ограничения исследования включают скромный размер образцов тканей и большое количество неклассифицированных таксонов. Для подтверждения наших результатов в будущем необходимы более крупная когорта в многоцентровых исследованиях и оптимизированные методы секвенирования. Тем не менее, наше исследование указывает на перспективность использования маркеров желудочных грибов в прогнозировании РЖ, описывая изменение гомеостаза микобиома желудочных грибов в канцерогенезе РЖ. Мы также обнаружили изменения в специфических для РЖ грибковых и иммунологических маркерах, что указывает на то, что синергетические взаимодействия хозяина и грибков могут способствовать патогенезу РЖ. Для содействия разработке терапевтических и диагностических мишеней против РЖ рекомендуется дальнейшее изучение взаимодействия между грибками, бактериями и хозяином.