В желудочно-кишечном тракте насчитывается 100 миллионов нейронов - непосредственно на линии огня - все они могут быть уничтожены кишечными инфекциями, что потенциально может привести к длительному заболеванию ЖКТ.
Но у кишечной инфекции может быть и положительная сторона. Новое исследование показало, что у мышей, инфицированных бактериями, развивается уникальная форма толерантности, совершенно не похожая на хрестоматийный иммунный ответ. Исследование, опубликованное в журнале Cell, описывает, как макрофаги кишечника отвечают на нападение, защищая нейроны энтеральной нервной системы, предотвращая их отмирание при последующем нападении патогенов. Эти результаты могут в конечном итоге иметь клинические последствия для таких заболеваний, как синдром раздраженного кишечника (СРК), который связан с гибелью нейронов кишечника.
"Мы описываем своего рода врожденную память, которая сохраняется после того, как первичная инфекция исчезла", - говорит руководитель исследования Дэниел Мусида. "Эта толерантность существует не для того, чтобы убивать новых патогенов, а для того, чтобы справляться с ущербом, который наносит инфекция - сохранять количество нейронов в кишечнике".
Известная как "второй мозг" организма, энтеральная нервная система является крупнейшим хранилищем нейронов и глии за пределами мозга. Собственная нервная система ЖКТ существует более или менее автономно, без существенного участия мозга. Она контролирует движение питательных веществ и отходов, координируя местный обмен жидкостей и кровоток с полномочиями, не встречающимися больше нигде в периферической нервной системе. Если погибает значительное количество этих нейронов, желудочно-кишечный тракт выходит из-под контроля.
В прошлом году Мусида и его коллеги сообщили, что кишечные инфекции у мышей могут убивать энтеральные нейроны грызунов, что приводит к катастрофическим последствиям для моторики кишечника. В то время исследователи отметили, что симптомы СРК в точности повторяют симптомы, которые можно ожидать при массовой гибели энтеральных нейронов, что дает возможность предположить, что незначительные кишечные инфекции могут уничтожать энтеральные нейроны у одних людей больше, чем у других, что приводит к запорам и другим необъяснимым состояниям ЖКТ.
Исследователи задались вопросом, есть ли в организме какой-то механизм предотвращения гибели нейронов после инфекции. В предыдущей работе лаборатория действительно продемонстрировала, что макрофаги в кишечнике производят специализированные молекулы, которые предотвращают гибель нейронов в ответ на стресс. Начала формироваться гипотеза. "Мы знали, что энтеральные инфекции вызывают гибель нейронов, и мы знали, что макрофаги предотвращают гибель клеток нейронов", - говорит Мучида. "Мы задались вопросом, действительно ли мы рассматриваем один механизм. Активирует ли предшествующая инфекция эти макрофаги для защиты нейронов при последующих инфекциях?".
Сотрудники лаборатории сначала инфицировали мышей несмертельным штаммом сальмонеллы, стандартного бактериального источника пищевых отравлений. Мыши избавились от инфекции примерно за неделю, потеряв при этом ряд энтеральных нейронов. Затем тех же мышей заразили другой аналогичной бактерией, передающейся с пищей. На этот раз у мышей не было дальнейшей потери энтеральных нейронов, что говорит о том, что первая инфекция создала механизм толерантности, который предотвратил потерю нейронов. Ученые обнаружили, что обычные паразитарные инфекции также оказывают подобное воздействие. "В отличие от патогенных бактерий, некоторые паразиты, например гельминты, научились жить внутри нас, не причиняя чрезмерного вреда тканям", - говорит он. Действительно, это семейство паразитов, в которое входят двуустки, ленточные черви и нематоды, заражают более тонким способом, чем враждебные бактерии. Но они также вызывают еще более сильную и далеко идущую защиту.
Во время первичной бактериальной инфекции, обнаружил Мусида, нейроны вызывают макрофагов, которые устремляются к этому месту и защищают уязвимые клетки от будущих атак. Однако когда гельминт проникает в кишечник, именно Т-клетки привлекают макрофаги, отправляя их в отдаленные участки кишечника, чтобы обеспечить защиту всего спектра энтеральных нейронов от будущего вреда. Таким образом, бактериальные и гельминтные инфекции разными путями приводят к защите энтеральных нейронов. Теперь Мусида надеется определить точное воздействие потери нейронов в желудочно-кишечном тракте. "Мы наблюдали, что животные потребляют больше калорий без увеличения веса после потери нейронов", - говорит он. "Это может означать, что потеря энтеральных нейронов также влияет на всасывание питательных веществ, обмен веществ и потребление калорий. Возможно, потеря нейронов имеет больше последствий, чем мы ожидали", - добавляет он.
Мусида считает, что это исследование может способствовать более полному пониманию глубинных причин СРК и сопутствующих заболеваний.
"Одно из предположений заключается в том, что количество энтеральных нейронов на протяжении всей жизни определяется инфекциями, перенесенными в раннем детстве, которые предотвращают потерю нейронов после каждой последующей инфекции,
- объясняет Мусида.
Люди, у которых по каким-то причинам не развивается толерантность, могут продолжать терять энтеральные нейроны на протяжении всей жизни с каждой последующей инфекцией. В ходе будущих исследований будут изучены альтернативные методы защиты энтеральных нейронов, что, возможно, проложит путь к созданию терапевтических средств.
Tomasz Ahrends et al. Энтеральные патогены вызывают толерантность тканей и предотвращают потерю нейронов при последующих инфекциях (аннотация).
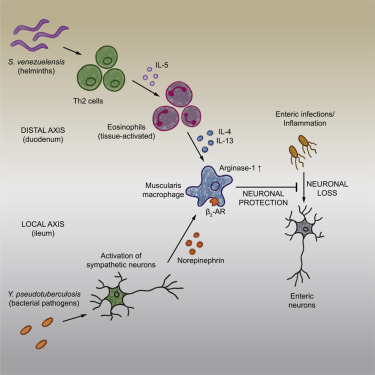
Энтеральная нервная система (ЭНС) контролирует несколько функций кишечника, включая подвижность и обработку питательных веществ, которые могут быть нарушены в результате вызванных инфекцией нейропатий или гибели нейронов. Мы исследовали возможные механизмы толерантности, предотвращающие потерю нейронов и нарушение подвижности кишечника после воздействия патогенов. Мы обнаружили, что после энтеральных инфекций мышечные макрофаги (ММ) приобретают тканезащитный фенотип, который предотвращает потерю нейронов, дисмоторику и поддерживает энергетический баланс при последующем воздействии неродственных патогенов.
Нейропротекция, вызванная бактериями, основывалась на активации симпатических нейронов кишечника и сигнализации через β2-адренергические рецепторы (β2AR) на ММ. В отличие от этого, нейропротекция, опосредованная гельминтами, зависела от Т-клеток и системной продукции интерлейкина (IL)-4 и IL-13 эозинофилами, которые индуцировали ММ, экспрессирующие аргиназу, что предотвращало потерю нейронов от неродственной инфекции, локализованной в другом отделе кишечника.
В совокупности эти данные позволяют предположить, что различные энтеральные патогены вызывают состояние толерантности к заболеванию или тканевой толерантности, которое сохраняет количество и функциональность ЭНС.