Наш кишечник содержит ~100 триллионов комменсальных бактерий, которые способствуют усвоению питательных веществ и иммунному созреванию и защищают хозяина от бактериальных инфекций.
Несмотря на это, многие энтеральные патогены, такие как Salmonella, Shigella, Yersinia и патогенная E. coli, разработали стратегии колонизации слизистой оболочки кишечника и вызывают заболевания. Эти патогены вызывают серьезную озабоченность в области общественного здравоохранения из-за их способности вызывать тяжелые диарейные и внекишечные заболевания и легкости передачи через загрязненную пищу и воду.
Сальмонеллы и другие энтерогенные патогены используют систему секреции III типа для вторжения в клетки хозяина, нацеливаясь на небольшое количество фолликуло-ассоциированных эпителиальных клеток (ФАЭ), известных как микрофолликулярные (М) клетки. Заражение сальмонеллами, даже в небольших количествах, может вызвать тяжелый энтерит и/или диссеминированные инфекции. Однако не совсем понятно, как небольшая порция патогенов попадает в уязвимую точку входа ФАЭ среди миллионов или миллиардов микробов-комменсалов.
Биоэлектричество, являющееся основой современной электрофизиологии, было продемонстрировано на различных видах и тканях, от представителей рода Dictyostelium до млекопитающих и от нейронов до эпителиальных тканей. Живые клетки поддерживают трансмембранный потенциал, имеющий решающее значение для многих клеточных функций. Поляризованные клеточные слои, такие как эпителий и эндотелий, генерируют электрические потенциалы с помощью асимметрично организованных каналов и насосов, играющих роль в миграции клеток и заживлении ран. Трансмембранный регулятор проводимости при муковисцидозе (CFTR) поддерживает трансэпителиальный потенциал в эпителиальных тканях, обеспечивая секрецию хлоридов и поддерживая транспорт бикарбонатов, что крайне важно для оптимального функционирования эпителия. Дисфункция CFTR, наблюдаемая при муковисцидозе, нарушает транспорт ионов и трансэпителиальный потенциал (ТЭП), что приводит к проблемам с желудочно-кишечным трактом.
Эпителиальный пейзаж кишечника демонстрирует морфологические и функциональные различия между ворсинчатым эпителием и ФАЭ. Эпителий ворсинок состоит из энтероцитов с микроворсинками для поглощения питательных веществ, в то время как ФАЭ содержит М-клетки, расположенные над пейеровыми ямками для отбора антигенов. Используя мышиную модель, мы обнаружили, что генерируемые инфекцией Salmonella электрические поля в эпителии кишечника способствуют развитию системных бактериальных инфекций. Мы наблюдали различия в ТЭП между ФАЭ и окружающим эпителием ворсинок.
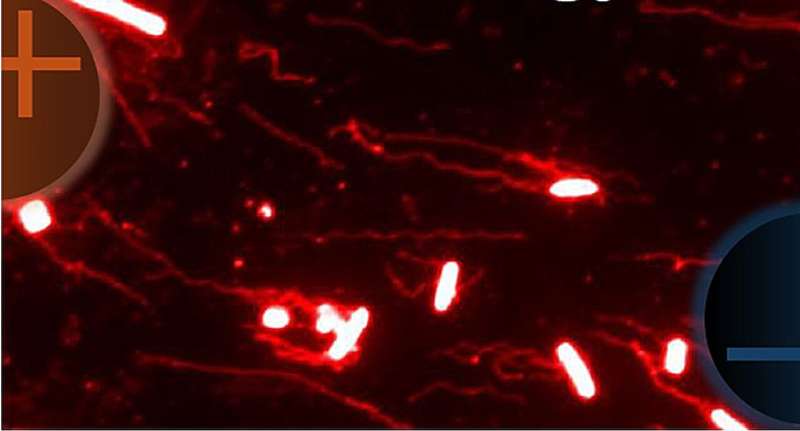
Однако неизвестно, как генерируются и организуются эти региональные биоэлектрические активности и как их конфигурация способствует нацеливанию патогенных бактерий. Salmonella enterica серотипа Typhimurium (S. Typhimurium) и комменсальные E. coli без О-антигена или с уменьшенным его количеством обладают различными электрическими свойствами поверхности и по-разному реагируют на электрические поля. Этот различный ответ определяется различием в пассивной электрофоретической подвижности их клеточного тела и жгутиковых нитей. Мы предположили, что энтеропатогены, такие как S. Typhimurium, используют гальванотаксический механизм для выбора мест инвазии.
Мы обнаружили, что S. Typhimurium нацеливается на ФАЭ, используя локальную, устойчивую биоэлектрическую сеть в эпителии кишечника, в то время как комменсальная кишечная палочка избегает ФАЭ. Этот процесс не зависит от хемотаксиса, так как мутанты сальмонеллы CheB, лишенные хемотаксиса, все равно подвергаются гальванотаксису и притягиваются к ФАЭ. В целом наши результаты свидетельствуют о том, что биоэлектрические сигналы способствуют нацеливанию S. Typhimurium на определенные места эпителия кишечника, что может иметь потенциальное значение в изучении других энтеральных бактериальных инфекций.