В ходе недавних доклинических исследований на моделях хронических заболеваний легких - бронхолегочной дисплазии (БЛД) и хронической обструктивной болезни легких (ХОБЛ) - вдыхание смеси живых бактерий Lactobacilli ослабляло воспаление легких и улучшало их функцию и структуру.
Исследование, опубликованное в журнале Nature Communications, определило механизм действия этого биотерапевтического продукта из живых бактерий Lactobacilli - на снижение нейтрофильного воспаления и уменьшение широкого спектра маркеров воспаления при БЛД и ХОБЛ, сообщает Харитхарт Вивек Лал, неонатолог из Университета Алабамы. По утверждению Лала, полученные авторами результаты «создают парадигму прогрессирования структурных заболеваний легких», поскольку определяют, что лактобациллы имеют решающее значение для регулирования активности протеаз легких, которая связана с разрушением, вызванным образованием пептида матрикина, оборотом внеклеточного матрикса и хроническим нейтрофильным воспалением, повреждающим альвеолы легких.
Возможная защитная роль лактобацилл для легких и возможность использования лактобацилл для лечения хронических заболеваний легких была обоснована в 2016 году, когда Лал и его коллеги обнаружили, что в дыхательных путях новорожденных с тяжелой бронхолегочной дисплазией было снижено количество лактобацилл, увеличено количество протеобактерий и повышена концентрация протеобактериального эндотоксина. В этом последнем исследовании ученые описали механизм действия лактобактерий, способствующий замедлению развития заболевания, а также продемонстрировали безопасность и эффективность живого биотерапевтического лечения в мышиной модели БЛД и трех мышиных моделях ХОБЛ.
Бронхолегочная дисплазия развивается у некоторых сильно недоношенных младенцев после повреждения, вызванного высоким давлением кислорода или применением искусственной вентиляции легких, необходимой для поддержания их жизни. ХОБЛ встречается у пожилых людей, особенно у курильщиков, и ежегодно уносит жизни около 3 миллионов человек во всем мире. «Ингаляционные живые биотерапевтические препараты показывают перспективность в устранении общих механизмов развития заболевания и в будущем они могут быть направлены на борьбу с различными заболеваниями легких», - уверен Лал. «Доклинические данные, полученные на животных, внушают оптимизм, а безопасность потенциального препарата на людях будет проверена в ходе предстоящего клинического испытания. Данные о безопасности препарата для взрослых людей при ХОБЛ помогут снизить риски на пути к одобрению применения препарата у новорожденных с бронхолегочными заболеваниями».
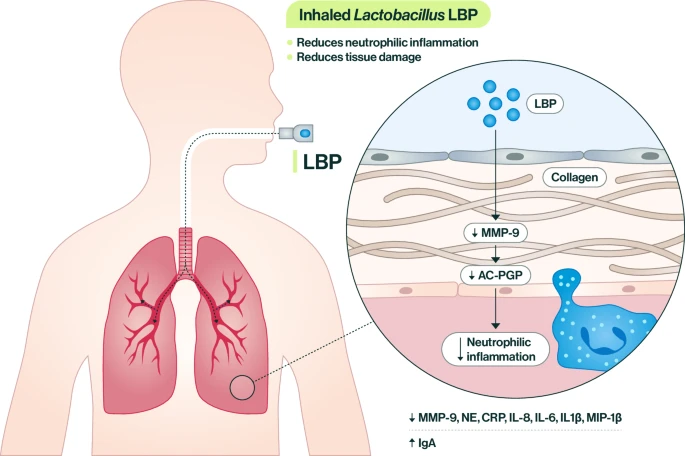
Исследователи предположили, что мышиные модели БЛД будут демонстрировать повышенный уровень ацетилированного пролин-глицин-пролина, или Ac-PGP, пептида, образующегося из внеклеточного матрикса, как это наблюдалось у недоношенных младенцев с БЛД. Это было продемонстрировано на мышиных моделях БЛД, а исследования по приобретению или потере функции показали влияние Ac-PGP. Интраназальная подача Ac-PGP усиливала нейтрофильное воспаление и деструкцию легких. Когда вместе с Ac-PGP вводился ингибитор Ac-PGP, маркеры нейтрофильного воспаления снижались, а структура легких улучшалась. Затем исследователи показали, что запатентованная смесь лактобацилл, состоящая из L. planatarum, L. acidophilus и L. rhamnosus, в синергии лучше всего снижает уровень воспалительной протеиназы MMP-9, которая способствует высвобождению Ac-PGP из внеклеточного матрикса. Более того, супернатант из среды роста Lactobacilli также снижал MMP-9 в той же степени, что и живые лактобациллы.
Ключевым открытием стало то, что L(+) молочная кислота, которая вырабатывается в супернатанте среды роста Lactobacilli, снижает MMP-9 in vitro, что свидетельствует о важной роли этой молочной кислоты как противовоспалительной молекулы. Исследователи обнаружили, что живые лактобактерии в легких обеспечивают постоянное, устойчивое высвобождение L(+) молочной кислоты контролируемым и хорошо переносимым способом.
Главным технологическим достижением, о котором сообщалось в исследовании, стало создание порошка ингаляционных лактобактерий с помощью технологии создания частиц достаточно мелких, чтобы проникнуть глубоко в легкие, сохранив при этом жизнеспособные бактерии. Затем этот живой биотерапевтический продукт был протестирован на моделях БЛД и ХОБЛ. В мышиных моделях ХОБЛ смесь успешно снижала воспаление в микросреде легких - как при одновременном лечении, так и после травмы, - демонстрируя противовоспалительный эффект, снижение нескольких провоспалительных маркеров и повышение уровня противовоспалительного маркера IgA.
Интересным открытием стала эффективность этого живого биотерапевтического продукта. Он снижал уровень MMP-9 и других провоспалительных цитокинов не хуже, а в некоторых случаях и лучше, чем флутиказона фуроат, ингаляционный кортикостероид, используемый в комбинированных препаратах для лечения ХОБЛ. Исследования безопасности и биораспределения в одной из моделей мышей с ХОБЛ показали, что вдыхание бактериального порошка не вызывало побочных реакций или осложнений, а лактобактерии не транслоцировались в дистальные ткани и не накапливались в легких.