Катетеризация мочевых путей - распространенная процедура отведения мочи из мочевого пузыря пациентов, страдающих хроническими заболеваниями или находящихся в медицинских учреждениях, отделениях интенсивной терапии, во время хирургических операций и восстановления.
Несмотря на свои преимущества, установка катетера повышает риск развития катетер-ассоциированной инфекции мочевыводящих путей (CAUTI). CAUTI являются одной из наиболее распространенных нозокомиальных инфекций и часто приводят к септицемии со смертностью 30%. Фактически, ~25% случаев сепсиса вызваны осложненными (инфекциями мочевыводящих путей (ИМП), включая CAUTI. Современное лечение CAUTI сосредоточено на удалении катетера, его замене и приеме антибиотиков. Однако постоянная колонизация катетеров внешней и фекальной микрофлорой, а также полимикробные инфекции создают трудности в управлении и лечении в связи с растущей распространенностью антибиотикорезистентных возбудителей CAUTI. Это привело к тому, что CDC и ВОЗ классифицировали CAUTI как серьезную угрозу.
В настоящее время не существует единого мнения о передовой практике лечения CAUTI. Пациентов лечат по тем же протоколам, что и при некатетерных (неосложненных) инфекциях мочевыводящих путей (неослИМП). Однако CAUTI имеют уникальные клинические проявления, возбудителей и патологические механизмы, что делает эти инфекции отличными от неослИМП. Например, неослИМП чаще встречаются у женщин, чем у мужчин (соотношение 4:1), в то время как при CAUTI гендерные различия отсутствуют. Кроме того, на долю кишечной палочки приходится >95% случаев неослИМП, в то время как возбудители CAUTI более разнообразны, включая грамотрицательные, грамположительные и грибковые патогены.
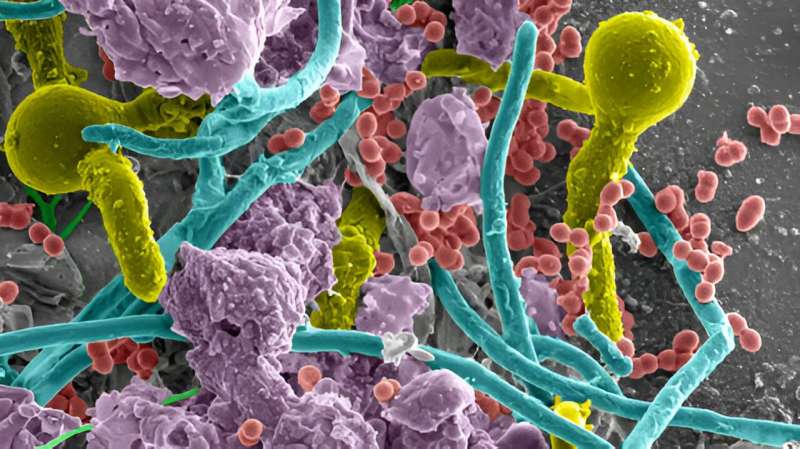
Как у людей, так и у мышей катетеризация вызывает локальное повреждение тканей мочевого пузыря, активируя коагуляцию и превращая белок свертывания крови, фибриноген (Fg), в фибрин. Фибриновые сгустки и внесосудистые отложения фибрина способствуют свертыванию крови и заживлению ран. Затем, в процессе фибринолиза, плазминоген (Pg) активируется плазмин сериновой протеазой для разрушения фибриновых сгустков и восстановления тканевого гомеостаза. Однако постоянное воспаление мочевого пузыря, вызванное катетером, приводит к накоплению Fg/фибрина на катетере с увеличением времени катетеризации у человека и мышей. Отложение Fg/фибрина нарушает состояние уротелия, создавая тем самым платформу для формирования биопленок патогенами CAUTI.
В данном исследовании мы обнаружили, что мыши с генетическим или приобретенным фибринолитическим дефицитом подвержены тяжелым и устойчивым CAUTI и системному распространению различных групп распространенных уропатогенов. Более того, мы обнаружили, что E. faecalis, распространенный возбудитель CAUTI, известный тем, что связывается с Fg, выделяет протеазу SprE, чтобы вызвать накопление фибрина и создать нишу идеальную для роста, формирования биопленок и персистенции в ходе CAUTI. Более того, применение антифибринолитических препаратов у катетеризированных мышей приводит к накоплению Fg/фибрина в мочевом пузыре, что приводит к персистированию CAUTI и системному распространению моно- и полимикробной инфекции E. faecalis, E. coli и C. albicans. Выявление популяций пациентов с повышенной восприимчивостью к CAUTI и ее последствиям позволит клиницистам улучшить результаты лечения пациентов путем внедрения эффективного мониторинга состояния пациентов для снижения частоты инфекций, заболеваемости и смертности.
Индукция E. faecalis накопления фибрина создает идеальные условия для формирования и сохранения биопленок в мочевом пузыре, который является открытой и динамичной системой, где непрерывно циркулирует моча. Накопление фибрина также способствует возникновению петли обратной связи Fg/интерлейкин-6. Это объясняет, как E. faecalis может процветать и использовать катетеризированный мочевой пузырь, несмотря на сильную воспалительную реакцию, а также как накопление фибрина способствует CAUTI и системному распространению других патогенов. Способность энтерококков модулировать среду мочевого пузыря в интересах себя и других патогенов может также объяснить, почему энтерококки описываются как один из наиболее часто встречаемых видов в мочевых катетерах. Это подтверждает результаты нескольких клинических исследований, показавших, что энтерококки являются ранними колонизаторами и сохраняются при длительной катетеризации в мономикробном или полимикробном взаимодействии.
При неослИМП E. coli использует пилус типа 1 для связывания маннозилированных рецепторов на поверхности уротелия, чтобы вторгнуться и сформировать внутриклеточные бактериальные сообщества (ВБС). Во время CAUTI, вызванного E. coli, образование ВБС значительно снижается, не влияя на общую колонизацию мочевого пузыря. Мы обнаружили, что Fg, который является высокогликозилированным, используется E. coli для колонизации мочевого пузыря и катетера в процессе CAUTI. Отложение Fg на уротелии может блокировать взаимодействие кишечной палочки с клетками, влияя на формирование ВБС. В подтверждение этого мы обнаружили, что уровень Fg/фибрина непосредственно влияет на CAUTI E. coli, уменьшая колонизацию, когда Fg был растворим или отсутствовал, и увеличивая колонизацию, когда накапливался фибрин. Растворимый Fg и другие гликозилированные белки хозяина, включая уромодулин , могут выступать в качестве рецепторов-«приманок», препятствующих связыванию с поверхностями мочевыводящих путей, что приводит к изгнанию патогена с потоком мочи. Напротив, накопление фибрина на поверхностях может служить платформой для адгезии E. coli, что противодействует ее выведению потоком мочи.
Учитывая распространенность катетеризации мочевых путей и рост числа патогенов с множественной лекарственной резистентностью, ожидается, что частота CAUTI будет продолжать расти. Данное исследование не только выявило механизмы, с помощью которых катетер-индуцированное воспаление предрасполагает пациентов к развитию CAUTI, но и определило популяции пациентов, которые будут подвержены повышенному риску развития CAUTI-ассоциированной септицемии, вызванной наиболее распространенными CAUTI-патогенами.
При сравнительном протеомном анализе катетеров человека и мышей мы обнаружили, что в катетерах человека количество депонированных белков было меньше, чем в катетерах мышей. Это можно объяснить стохастическим характером осаждения белков под действием потока мочи или при извлечении катетера из носителя. Например, при удалении катетера у пациента необходимо протянуть катетер через уретру, что может привести к случайному удалению некоторых белков. Несмотря на это, общие белки участвуют в тех же путях развития хозяина, что еще раз подтверждает, что наша мышиная модель CAUTI точно повторяет патофизиологию человеческой CAUTI, и позволяет предположить, что наши результаты могут быть использованы для профилактики и лечения человеческих CAUTI. Использование этих результатов для разработки более совершенных стратегий выявления пациентов из группы риска и обоснования рекомендаций по катетеризации позволит повысить качество жизни пациентов и свести к минимуму риск осложнений.