Поначалу ошибочно принятая за нейтрофилы, популяция атипичных макрофагов появляется в легких после тяжелой вирусной инфекции, организует восстановление тканей, а затем исчезает.
В разгар пандемии SARS-CoV-2 исследователи из лаборатории иммунофизиологии Томаса Маришаля в Льежском университете изучали образцы, взятые из легких пациентов, выздоровевших от тяжелой формы COVID-19. Они сделали поразительное наблюдение. «Мы ожидали увидеть нейтрофилы или Т-клетки, но количество макрофагов в образцах было огромным», - говорит Маришаль. «Обычно они не присутствуют в здоровых легких [в большом количестве], так что это было действительно интересно и интригующе». Макрофаги, образующиеся из моноцитов, массово рекрутировались в легкие в течение короткого периода времени сразу после вирусной инфекции, поэтому Маришаль и его коллеги не могли понять, почему они появились в таком большом количестве в легких людей, которые уже выздоровели от инфекции.
Примерно в то же время аспирантка Маришаля Сесилия Рускитти работала с мышиной моделью вируса гриппа А (IAV) и была увлечена исключительно транзиторной популяцией клеток. Первоначально исследователи предположили, что эти клетки являются нейтрофилами, основываясь на экспрессии Ly6G, поверхностного маркера, используемого для сортировки нейтрофилов от других клеток. Подобно макрофагам, которые Маришаль наблюдал в образцах COVID-19, эти нейтрофилоподобные клетки появлялись в фазе восстановления после тяжелого вирусного заболевания. Затем они исчезали. «Чем больше мы смотрели на эти клетки, тем больше я убеждался, что на самом деле это не нейтрофилы, а макрофаги», - рассказывает Маришаль.
В недавнем исследовании, опубликованном в журнале Science Immunology, Маришаль и его коллеги подтвердили, что эти необычные клетки, появившиеся после заражения вирусом IAV, являются макрофагами и что они способствуют восстановлению альвеол в легких после тяжелых вирусных инфекций у мышей. Полученные результаты свидетельствуют о новой популяции макрофагов, на которую можно направить терапевтическое воздействие для лечения повреждений легких. «Эти результаты очень надежны - они охватывают все базовые аспекты», - прокомментировала Кирстен Спанн, вирусолог из Квинслендского технологического университета, не принимавшая участия в исследовании. «Авторы действительно изучили механизм, как именно этот подтип макрофагов индуцируется в модели гриппозной инфекции у мышей, так что данные и методы, которые они использовали, очень надежны».
Когда исследователи провели проточную цитометрию атипичных Ly6G+ клеток, собранных из образцов легких мышей, инфицированных IAV, обнаружились дополнительные поверхностные маркеры, которые сигнализировали исследователям, что перед ними нечто отличное от нейтрофилов. «Основная причина, по которой я думаю, что эти клетки никогда не встречались ранее, заключается в том, что специалисты в области макрофагов не заинтересованы в исследовании нейтрофилов, поэтому они просто удаляют их на основании маркера Ly6G, и они также удалили эти макрофаги из своего анализа», - предположил Маришаль.
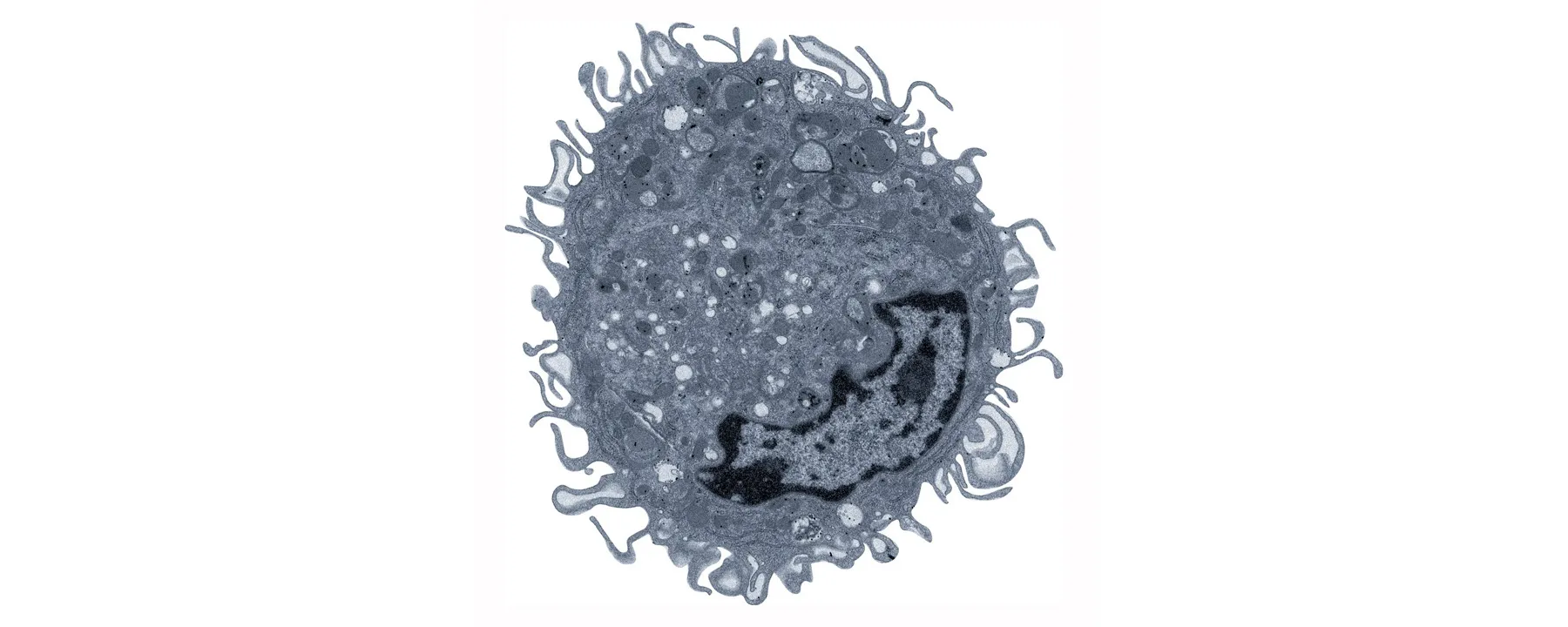
Последующие эксперименты по секвенированию РНК в одиночных клетках и трансмиссионной электронной микроскопии подтвердили, что макрофаги Ly6G+ отличаются от нейтрофилов. По словам Маришаля, во время тяжелых респираторных заболеваний, таких как COVID-19 или IAV, в легких образуются участки повреждения альвеол, нарушающие газообмен. После того как инфекция проходит, повреждения восстанавливаются клетками-предшественниками, которые дифференцируются в эпителиальные клетки, образующие новые альвеолы. Используя конфокальную микроскопию для изучения легких мышей, которые перенесли IAV-инфекцию, авторы исследования обнаружили макрофаги Ly6G+, расположенные рядом с поврежденной тканью в пространстве между альвеолами, где они группировались вместе с прогениторными клетками. Исследователи предположили, что макрофаги Ly6G+ организуют восстановление повреждений, давая указания клеткам-предшественникам.
Дальнейшие эксперименты подтвердили, что Ly6G+ макрофаги выделяют растворимые факторы, которые инструктируют клетки-предшественники пролиферировать и дифференцироваться. Они обнаружили, что эта функция частично зависит от сигнализации через рецептор интерлейкина-4 (IL-4), который, как известно, вызывает фенотип репарации у других макрофагов. Чтобы изучить все возможности этих интересных клеток, авторы обратили внимание на другие типы повреждений и различные органы. Они обнаружили, что макрофаги Ly6G+ восстанавливают легкие и печень мышей после повреждений, вызванных лекарственными препаратами. Кроме того, они показали, что моноцитарные макрофаги, присутствующие в образцах легочной жидкости людей с подозрением на пневмонию, транскрипционно схожи с Ly6G+ макрофагами у мышей.
Маришаль и его коллеги заявили, что их результаты могут проложить путь к новым методам лечения, способствующим регенерации легких после травм и перенесенных заболеваний. Например, лечение на основе IL-4 может стимулировать дифференцировку Ly6G+ макрофагов и впоследствии ускорить пролиферацию прогениторных клеток и восстановление. «Принимайте во внимание, что у вас будет меньше контроля над этим вариантом, [потому что] моноциты довольно пластичны», - предупреждает Спанн. «Поэтому вы не всегда можете быть уверены, что, если вы будете манипулировать моноцитами, они действительно дифференцируются в полезные макрофаги, а не во вредные».