На поле боя человеческого тела микробы используют все свои навыки, чтобы маскироваться, проникать в организм, манипулировать им и уклоняться от иммунной защиты.
Поклонники шпионского жанра наверняка согласятся, что любой достойный противник должен обладать определенным чутьем, сочетанием обмана и манипулирования. Внутри человеческого тела иммунная система сталкивается с аналогичной угрозой со стороны микробов-хитрецов, которые стремятся преодолеть защитные силы организма, чтобы обеспечить себе выживание. Чтобы незаметно перемещаться по телу хозяина, эти крошечные нарушители спокойствия - грибки, бактерии, вирусы и паразиты - выработали стратегии, позволяющие скрыть себя от иммунологического контроля. На протяжении многих лет исследователи настойчиво и изобретательно раскрывали эти обманные тактики, чтобы определить стратегии, способные изменить баланс в пользу человека.
Plasmodium falciparum: паразит, который превосходно маскируется
В XIX веке врач-паразитолог Шарль Луи Альфонс Лаверан впервые обнаружил паразитов Plasmodium, исследуя образцы крови пациентов, страдающих малярией. После открытия Лаверана исследователи попытались составить схему жизненного цикла паразита. Позволив комарам питаться кровью зараженных малярией пациентов, врач Рональд Росс первым обнаружил паразитов в желудке насекомых и предположил, что малярийный паразит передается через укусы комаров.
С тех пор сложный жизненный цикл этих одноклеточных простейших завораживает исследователей по всему миру, в том числе микробиолога Кирка Дейча. В 1990-х годах Дейч впервые узнал о плазмодиях, изучая механизмы регуляции генов у комаров под руководством энтомолога и паразитолога Александра Райхеля. В то время исследователи знали, что некоторые бактерии и простейшие, в том числе Trypanosoma и Plasmodium, обладают необыкновенной способностью быстро менять молекулы, которые они выставляют на обозрение иммунной системе хозяина, - этот процесс известен как антигенные вариации.
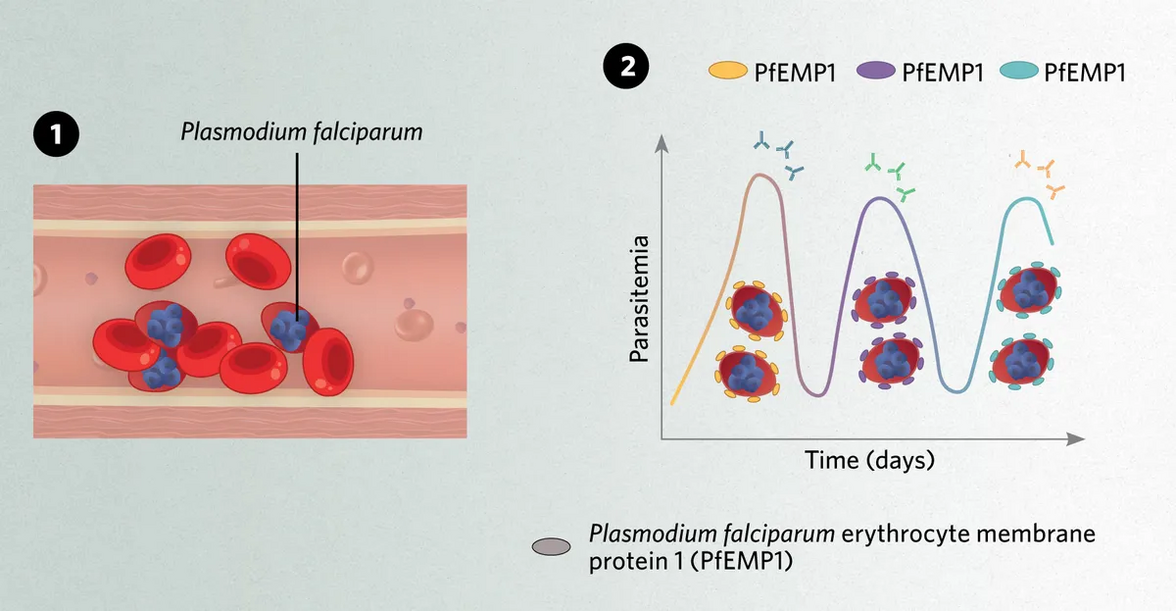
Поскольку малярийные паразиты прячутся внутри эритроцитов, механизм их антигенной вариации включает в себя переключение продуцируемых паразитом молекул на поверхности инфицированных эритроцитов. В конкретном случае P. falciparum - самого смертоносного вида Plasmodium, вызывающего малярию у людей, - этот феномен опосредован дифференциальной экспрессией белка, называемого мембранным белком эритроцитов P. falciparum 1 (PfEMP1). Поскольку инфицированные плазмодием эритроциты отклоняются от классической двояковогнутой формы, они чаще удаляются из циркуляции и уничтожаются селезеночным клиренсом. «Паразит выводит этот белок PfEMP1 через мембрану эритроцита», - объясняет Дейч. «Он служит липучкой, прикрепляющей [клетку] к стенке кровеносного сосуда, поэтому она не проходит через селезенку».
Когда Дейч был аспирантом, группа исследователей под руководством Томаса Веллемса из Национального института аллергии и инфекционных заболеваний США случайно наткнулась на большое и изменчивое семейство генов var, которые кодировали белок PfEMP1. «У каждого паразита было 60-70 генов var, и каждый из них кодировал разные формы этого белка», - рассказывает Дейч, который впервые узнал об этих открытиях на семинаре, который Веллемс проводил в его институте. «Я тогда подумал, что это самая крутая загадка в мире», - вспоминает он.
Мотивированный решить эту загадку, Дейч присоединился к лаборатории Веллемса в качестве постдокторанта в 1996 году. В то время Веллемс и его сотрудники занимались поиском генов, позволяющих паразитам Plasmodium противостоять противомалярийным препаратам, в частности хлорохину - синтетическому лекарству, используемому для лечения болезни с 1960-х годов. Дейч вспоминает, как в первый день работы в лаборатории Веллемса познакомился с другими членами группы, включая Синь-Чжуань Су, который возглавлял исследование устойчивости к хлорохину и открыл гены var. Он пошел в морозильную камеру и вернулся с коробкой, на которой было написано GFH, и я спросил: «Что означает GFH?», а он ответил: «Это значит „гены из ада“ (go from hell)», - вспоминает Дейч. «Он пытался найти ген устойчивости к хлорохину, и эти штуки постоянно мешали ему, из-за чего картировать хромосомы было очень сложно. Это был кошмар для него».
В последующие годы Дейч углубился в изучение регуляции антигенного переключателя P. falciparum. Он и его коллеги обнаружили, что спонтанные рекомбинации приводят к переключениям в экспрессии генов var в пределах кластера этих генов в 12-й хромосоме паразита, и это явление не регулируется вариациями в последовательности промотора или изменениями в транскрипционных факторах.
В следующем исследовании ученые изучили, как P. falciparum одновременно экспрессирует только один ген var - явление, называемое взаимоисключающей экспрессией. Группа исследовала, могут ли консервативные интроны в этих генах быть источником сайленсинга промотора var. Трансфицировав P. falciparum репортерными конструкциями, они обнаружили, что последовательность интронов подавляет экспрессию репортерного гена под контролем промотора var, что говорит о сотрудничестве между некодирующими последовательностями и промоторными областями в регуляции феномена взаимоисключающей экспрессии.
Продолжая изучать антигенные вариации у P. falciparum, Дейч убедился, что эпигенетические механизмы тоже играют определенную роль в этом процессе. Среди хорошо известных эпигенетических изменений известны модификации гистонов, которые регулируют доступность генов для транскрипционного механизма путем ослабления или ужесточения взаимодействия гистонов с ДНК. Группа Дейча изучила изменения гистонов у P. falciparum, используя маркерный ген устойчивости к лекарственному препарату бластицидину для управления экспрессией одного гена var, и обнаружила, что метилирование третьего гистона служит маркером глушения генов у паразита. Примерно в то же время другие исследователи также описали ключевую роль изменений гистонов в глушении и активации генов var.
«Паразиты пользуются механизмом, очень похожим на то, что происходит у высших эукариот в плане эпигенетической активации и глушения генов», - отмечает Дейч.
У представителей рода Plasmodium есть целый репертуар генов var, которые активно сменяют друг друга в течение инфекции; однако вопрос о том, как они узнают, когда нужно начинать смену, заинтриговал Дейча. Долгие годы исследователи считали, что малярийные паразиты эволюционировали с присущей им скоростью смены генов, которая соответствует времени, требующемуся их хозяевам для создания эффективного ответа антител, объясняет Дейч. «Мы заинтересовались тем, не слишком ли это упрощенно, и действительно ли паразиты чувствуют окружающую среду», - рассказал он.
Снизив или повысив уровень питательных веществ в культуральной среде для паразитов, необходимой для метаболизма S-аденозилметионина (SAM), основного источника метила для метилирования гистонов, Дейч и его коллеги показали, что изменения в наличии SAM влияют на экспрессию var у P. falciparum, что говорит о том, что паразиты могут чувствовать изменения в окружающей среде.
Хотя исследователи расшифровали многие аспекты жизненного цикла паразита и некоторые его уловки для обхода иммунитета, одноклеточное простейшее все еще хранит множество секретов. Дейч считает, что одна из нерешенных проблем заключается в том, как паразиты меняют регуляцию генов var по мере того, как они переселяются в своего комариного хозяина или впервые проникают в эритроциты. В сотрудничестве с Фотини Синни из Университета Джона Хопкинса, он изучает, как малярийные паразиты узнают, когда включать гены var, когда они покидают печень - орган, который паразиты используют для первоначальной репликации и развития в другую форму, - и попадают в кровь, чтобы инфицировать эритроциты. «Мы начинаем разрабатывать методы, которые позволят нам изучить все это в деталях, чего мы не могли сделать в прошлом», - говорит он.
Модифицировано из © istock.com, Shivendu Jauhari, Irfan Setiawan, Eranicle
1) Малярийный паразит Plasmodium falciparum экспрессирует белок PfEMP1 на поверхности эритроцитов, чтобы приклеить их к стенкам кровеносных сосудов и избежать очищения селезенкой.
2) PfEMP1 может быть обнаружен иммунными клетками. Благодаря процессу антигенной вариации P. falciparum экспрессирует различные его версии и избегает иммунного распознавания.
Внутриклеточные манипуляции микобактерий туберкулеза
Mycobacterium tuberculosis на протяжении десятков тысяч лет разрабатывала стратегии выживания в условиях враждебной иммунной системы человека. По мнению Дженнифер Филипс, врача-инфекциониста и исследователя из Вашингтонского университета, такая длительная коэволюция с человеком делает M. tuberculosis особенно уникальной бактерией. «Существует очень мало бактерий, способных вызвать хроническую инфекцию, как это делает M. tuberculosis, которые могут скрываться в течение очень долгого времени и не быть уничтоженными», - говорит она.
«Можно вспомнить вирусы, но если говорить о бактериях, то [M. tuberculosis] - непревзойденна в хронизации инфекции».
В начале 2000-х годов Филипс пыталась понять взаимодействие микобактерии и ее хозяина, изучая факторы, которые могут повлиять на проникновение и выживание патогена в макрофагах - типе миелоидных клеток, которые являются основной мишенью для этого внутриклеточного патогена. Поэтому она прошла постдокторскую стажировку под совместным руководством генетика из Гарвардского университета Норберта Перримона и исследователя туберкулеза Эрика Рубина.
Чтобы получить широкое представление о факторах хозяина, необходимых для выживания микобактерий, Филипс обратилась к хорошо изученной модели мушки Drosophila melanogaster, которая позволила ей провести скрининг РНК-интерференции (RNAi) в масштабах всего генома. Она заразила клетки D. melanogaster S2, похожие на макрофаги, микобактерией Mycobacterium fortuitum, родственной M. turberculosis.
Для отслеживания роста бактерий в клетках она создала мутантов, у которых экспрессия зеленого флуоресцентного белка происходила под контролем макрофаг-активируемого промотора - участка ДНК, содержащегося в генах, которые преимущественно экспрессируются, когда бактерии находятся внутри макрофагов. Она обнаружила, что RNAi нокдаун генов хозяина, участвующих в трафике везикул и организации цитоскелета, снижает инфекцию M. fortuitum. В последующем исследовании Филипс и ее коллеги изучили еще одну подгруппу факторов, выявленных в ходе первоначального анализа, которая включала членов механизма эндосомного сортировочного комплекса, необходимого для транспорта (ESCRT) - набора белковых комплексов, участвующих в сортировке и трафике убиквитилированных белков из эндосом в лизосомы. Нокдаун компонентов механизма ESCRT в клетках плодовой мушки S2 и макрофагах млекопитающих создал фагосомный сегмент, более благоприятный для роста микобактерий, выявив ранее неизвестную роль механизма ESCRT в трафике бактерий.
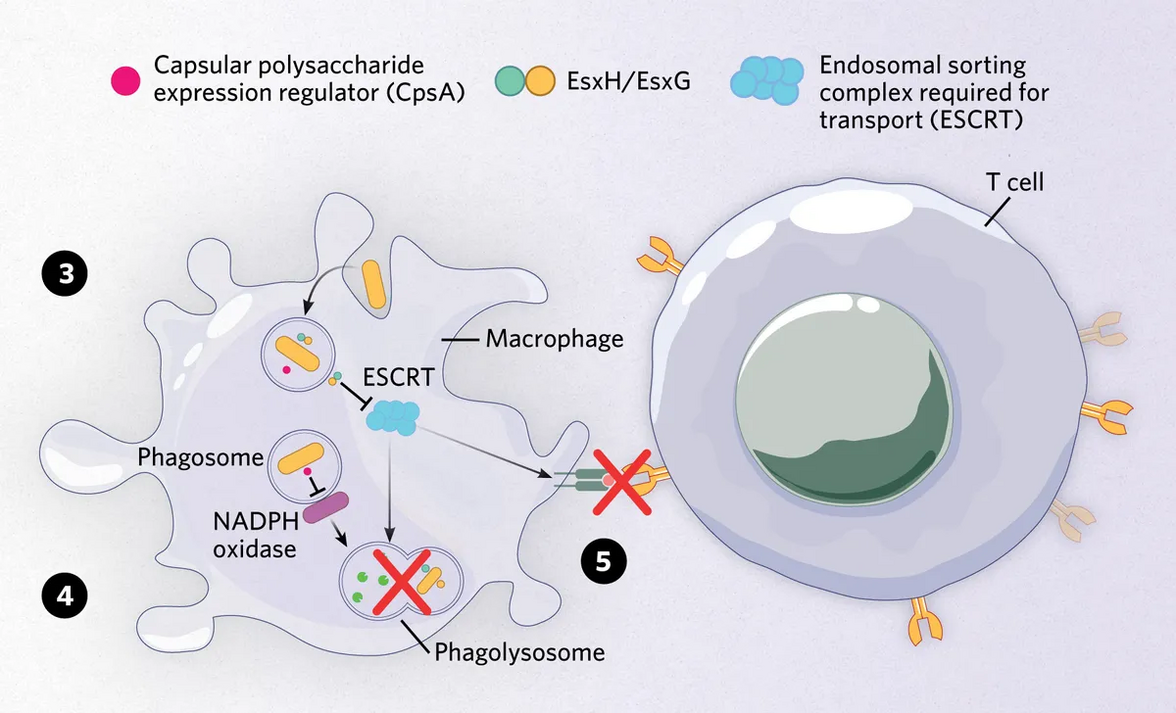
В последующие годы Филипс сосредоточила свое внимание на патогене, ища факторы вирулентности, которые могли бы способствовать его умению нарушать механизм ESCRT и избегать внутриклеточной гибели. Она сосредоточилась на системах секреции M. tuberculosis типа VII, которые отправляют субстраты за пределы клетки и являются ключевыми в патогенезе бактерий. Изучив взаимодействие молекул, выделяемых микобактериями, и белков хозяина, она обнаружила, что EsxH и EsxG, эффекторные белки, выделяемые системой секреции типа VII ESX-3, взаимодействовали с механизмом ESCRT и нарушали доставку патогена в лизосомы. «Нацеливаясь на механизм ESCRT, [EsxH и EsxG] оказывают действительно широкий спектр воздействия на макрофаги, и часть этого воздействия заключается в предотвращении нормального созревания фагосом», - поясняет Филипс.
Поскольку M. tuberculosis обосновывается внутри антигенпрезентирующих клеток, таких как макрофаги и дендритные клетки, бациллы способны нарушить взаимодействие между врожденным и адаптивным иммунным ответом. Макрофаги и дендритные клетки предоставляют патогенные антигены Т-клеткам CD4 через главный комплекс гистосовместимости класса II (MHC-II). Механизм ESCRT играет роль во внутриклеточной сортировке и транспортировке, поэтому Филипс и ее коллеги задались вопросом, могут ли эффекторы микобактерий также влиять на презентацию антигенов MHC-II. Используя макрофаги, полученные из костного мозга, исследователи показали, что механизм ESCRT способствует обработке антигенов, а комплекс M. tuberculosis EsxH-EsxG нарушает презентацию антигенов.
«Именно это взаимодействие между макрофагами и Т-клетками является частью фундаментальной проблемы в иммунной способности хозяина очищать организм от [M. tuberculosis]», - объясняет Филипс. «Потому что даже если вы создаете действительно хорошие Т-клетки, они не взаимодействуют с инфицированными макрофагами должным образом. Они не выполняют свою антимикробную функцию».
Недавно Филипс и ее коллеги обратили внимание на другие эффекторы, имеющиеся в арсенале бацилл, включая секретируемый белок CpsA, который входит в семейство белков, необходимых для поддержания клеточной стенки у грамположительных бактерий. Группа Филипс обнаружила, что CpsA является ключевым для M. tuberculosis, позволяющим избежать неканонического пути аутофагии путем нарушения генерации реактивных форм кислорода в фагосоме и ее созревания в антибактериальную фагосому.
Микобактерии туберкулеза вторгаются в иммунные клетки и используют целый ряд тактических приемов, чтобы избежать внутриклеточного уничтожения. Фото: Jully Sadadiwala.
Поскольку в течение заболевания M. tuberculosis инфицирует множество различных типов макрофагов, Филипс изучает, как микобактериальные эффекторы модулируют эти различные клеточные популяции. В исследовании, опубликованном в начале прошлого года, ее группа изучила клетки легких мышей, инфицированных M. tuberculosis, и показала, что CpsA необходим для распространения микобактерий от тканевых макрофагов к миелоидным клеткам, которые рекрутируются в очаг инфекции и в интерстиций легких.
По словам Филипс, лучшее понимание хитроумных механизмов патогена может не только помочь ученым разработать более эффективные терапевтические средства для борьбы с заболеванием, но и дать представление о том, как микобактерия использует различные способы атаки во время инфекции. «[M. tuberculosis] приходится делать очень разные вещи, чтобы поддерживать динамику инфекции. Изначально она должна быть как бы незаметной и мы даже не знаем, что человек инфицирован. А для того чтобы передаться другому человеку, ей необходимо нанести огромный ущерб тканям и вызвать гипервоспаление», - объясняет она. «Вот почему я считаю, что эта бактерия действительно понимает иммунную систему так, как мы не понимаем. Она знает, как быть незаметной и тихой, а затем как вызвать сильные разрушения, когда она собирается передать инфекцию».
Модифицировано из © istock.com, ttsz
3) Внутри макрофагов Mycobacterium tuberculosis уклоняется от внутриклеточной деградации, выделяя факторы вирулентности. Два эффектора, EsxH и EsxG, ингибируют функцию механизма ESCRT, нарушая созревание фагосом, несущих бактерии.
4) Другой фактор вирулентности микобактерий, CpsA, нарушает другой путь деградации и блокирует активность NADPH-оксидазы, препятствуя уничтожению бактерий.
5) Нарушая нормальную функцию ESCRT, комплекс M. tuberculosis EsxH-EsxG также нарушает процесс антигенной презентации через молекулу MHC-II.
ВИЧ - контролер молекул хозяина
Когда речь заходит о микроорганизмах-невидимках, вирусы также используют хитроумные стратегии, чтобы обмануть защитные силы иммунной системы. Оливье Шварц, вирусолог из Института Пастера, уже более трех десятилетий заинтригован тактикой, которую использует вирус иммунодефицита человека (ВИЧ).
Ретровирус, атакующий ключевых игроков иммунной системы, включая антигенпрезентирующие клетки и, прежде всего, Т-клетки CD4, ослабляет иммунную систему и вызывает синдром приобретенного иммунодефицита (СПИД) на самой поздней стадии инфекции. Спустя более 40 лет после того как были опубликованы первые сообщения о редком и смертельно опасном заболевании, СПИД стал управляемым хроническим состоянием здоровья благодаря использованию антиретровирусной терапии. Однако он по-прежнему остается неизлечимым заболеванием.
В конце 1980-х годов Шварц начал изучать ВИЧ-1, наиболее распространенный тип ВИЧ, в качестве стажера в лаборатории вирусолога Института Пастера Люка Монтанье, который несколькими годами ранее помог открыть этот вирус. В то время эта лаборатория занималась поиском новых лекарств, способных бороться с ВИЧ-1, и работа Шварца была направлена на тестирование некоторых из этих потенциальных противовирусных соединений. Когда Шварц начал учиться в аспирантуре, он присоединился к лаборатории исследователей Института Пастера Оливье Даноса и Жана-Мишеля Херда и углубился в биологию патогена, сосредоточившись на белках, кодируемых небольшим вирусным геномом.
В частности, он исследовал белок негативного фактора (Nef) - молекулу, которую вирус экспрессирует на ранних стадиях вирусного цикла и локализует в основном в цитоплазме инфицированной клетки. Предыдущие работы по изучению имитационного вируса иммунодефицита (SIV) показали, что Nef играет ключевую роль в поддержании высокой вирусной нагрузки и патогенности вируса у макак-резусов.
Исследователи также показали, что ВИЧ-1 снижает экспрессию основного комплекса гистосовместимости класса I (MHC-I), который, наряду с MHC-II, играет центральную роль в презентации антигенов. Чтобы выяснить, способствует ли Nef выживанию вируса путем снижения уровня MHC-I, Шварц и его коллеги сравнили экспрессию этого белка в клетках, инфицированных контрольными и nef-мутантными вирусными частицами. Экспрессия Nef снижала уровень MHC-I на поверхности клеток, стимулируя интернализацию и последующую деградацию молекулы. «В то время это было чем-то необычным. Ранее не было описано, что вирусный белок способен отключать эту важную иммунную молекулу для защиты инфицированных клеток», - рассказывает Шварц.
Несколько лет спустя, будучи уже руководителем группы в Институте Пастера, Шварц в сотрудничестве с Филиппом Бенарошем, иммунологом из Института Кюри, обнаружил, что ВИЧ-1 Nef снижает экспрессию зрелых молекул MHC-II, раскрывая еще одну вирусную хитрость, чтобы блокировать индукцию надлежащего противовирусного ответа.
Группа Шварца также обнаружила, что нарушение внутриклеточной транспортировки, вызванное Nef, выходит за рамки его воздействия на молекулы MHC. В середине 2000-х годов исследователи выяснили, может ли этот белок также нарушать формирование иммунологических синапсов - специализированных структур, которые позволяют антигенпрезентирующим клеткам и Т-клеткам взаимодействовать и генерировать эффективный Т-клеточный ответ против инфекционного агента. Используя частицы ВИЧ-1 дикого типа и nef-дефицитные, исследователи показали, что Nef индуцирует формирование аномальных иммунологических синапсов, в которых отсутствуют рецепторы Т-клеток, а также другие молекулы, важные для формирования и функционирования структуры.
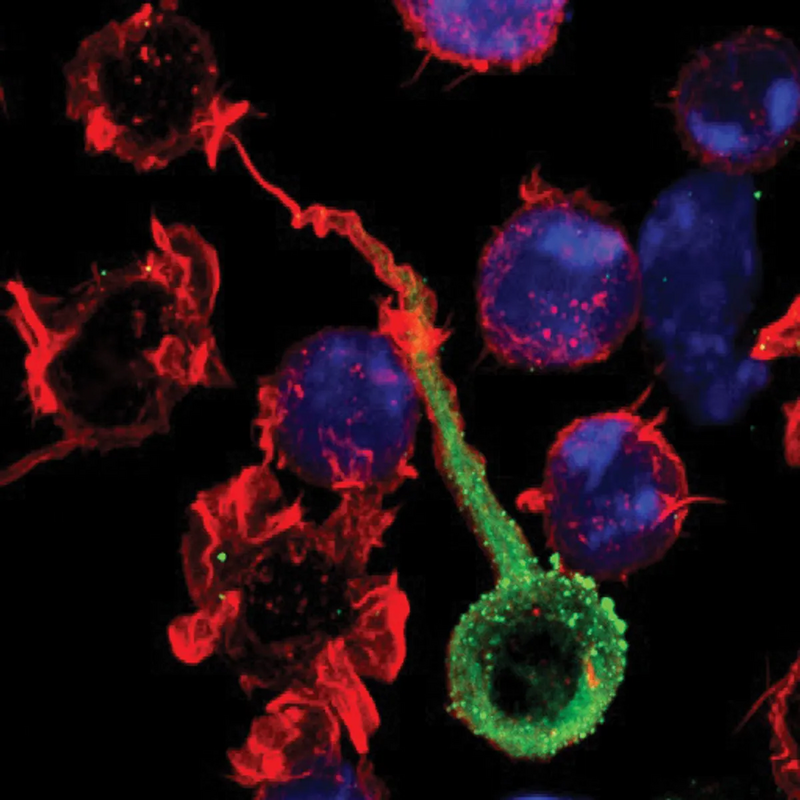
Частицы ВИЧ (зеленые) перемещаются из одной клетки в другую при прямом контакте инфицированной клетки с неинфицированной соседней клеткой (красной). Фото: Olivier Schwartz.
«ВИЧ или SIV действительно находятся в самом сердце иммунной системы, потому что они инфицируют клетки, которые обычно существуют для борьбы с инфицированными клетками», - говорит Шварц. «Нарушая эту сеть взаимодействий, [вирус] способствует возникновению стойкой инфекции и это одна из причин, почему от него очень трудно избавиться».
Свободные вирусные частицы часто считаются основным путем передачи вируса другим клеткам, однако частицы ВИЧ-1 могут передаваться и при прямом контакте между инфицированными и соседними неинфицированными клетками. Этот способ передачи включает в себя образование вирусологических синапсов - контактных зон между клетками, в которых концентрируются размножающиеся вирусные частицы, и рецепторами, с которыми связывается вирус.
Изучая передачу ВИЧ-1 от клетки к клетке, Шварц и его сотрудники показали, что Nef увеличивает локализацию группоспецифического антигена (gag), основного вирусного структурного белка, в клеточной мембране, а также способствует передаче вируса путем прямого контакта между клетками. «Для ВИЧ, да и для других вирусов, я думаю, что инфекционным объектом является скорее сама инфицированная клетка, а не внеклеточные вирусные частицы», - объясняет Шварц. «Важно и другое, но как только клетка заражена, она может производить много вирусных частиц, и они будут перемещаться".
"В каком-то смысле это похоже на лодку с множеством вирусных пассажиров».
По словам Шварца, несмотря на значительные успехи в понимании биологии ВИЧ и разработку новых терапевтических средств для лечения СПИДа, до сих пор остаются нерешенные вопросы. Одной из загадочных и сложных тем является латентный вирусный резервуар, который состоит из ВИЧ-инфицированных клеток, сохраняющихся в организме без активного производства новых вирусных частиц. Шварц также активно изучает вопрос о том, какой вклад в патогенез ВИЧ могут вносить другие патогены.
«Мы знаем, что вирус предпочитает реплицироваться в активных клетках, а активация лимфоцитов может быть вызвана другими микроорганизмами», - пояснил он. Недавно его группа обнаружила, что присутствие некоторых бактерий, включая Escherichia coli и Acinetobacter baumannii, активирует Т-клетки, которые, в свою очередь, демонстрируют более активную репликацию ВИЧ-1. «Это область исследований, которая заслуживает дальнейшего изучения», - подчеркнул Шварц.
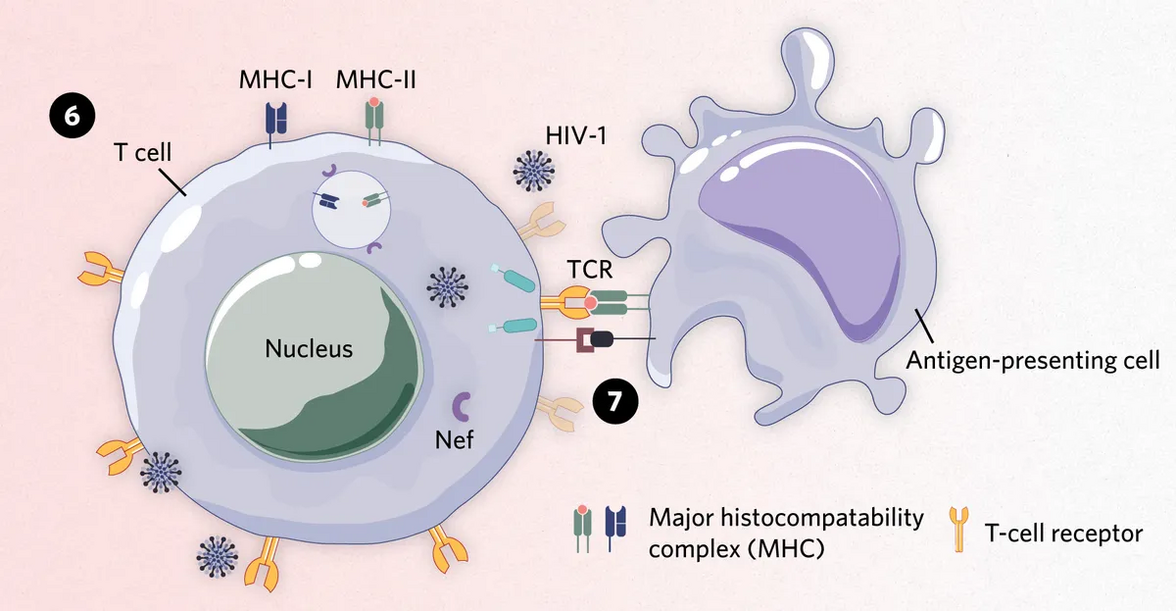
Модифицировано из © istock.com, ttsz, bombuscreative.
6) Чтобы оставаться незамеченным внутри лимфоцитов, ВИЧ-1 экспрессирует вирусные факторы, такие как белок негативного фактора (Nef). В инфицированной клетке Nef снижает экспрессию MHC-I и MHC-II на клеточной поверхности, нарушая презентацию вирусных антигенов.
7) Nef также нарушает правильное формирование иммунологических синапсов - точек связи между Т-клетками и антигенпрезентирующими клетками.
Метаморфозы Candida albicans.
Грибки в большинстве своем обитают в человеческом организме в качестве комменсалов, но различные факторы могут нарушить эти гармоничные отношения, что приводит к тяжелым грибковым инфекциям, уносящим жизни 2,5 миллионов человек в год по всему миру. Один из таких примеров - Candida albicans, грибки, часто встречающиеся на коже человека, во рту, желудочно-кишечном тракте и влагалище. «Большинство из нас на определенном этапе своей жизни абсолютно безвредно колонизированы Candida albicans. Поэтому очень интригует то, как этот организм может быть доктором Джекилом и мистером Хайдом, живя в гармонии большую часть времени, а затем, при других условиях, быть действительно опасным для жизни заболеванием», - говорит Нил Гоу, медицинский миколог из Эксетерского университета, который изучает царство грибков уже более 40 лет.
Интерес Гоу к тайнам, лежащим за пределами видимого невооруженным глазом, побудил его заняться микробиологией, и именно во время учебы в аспирантуре под руководством Грэма Гудея из Абердинского университета он обратил свое внимание на C. albicans. «Я работал в одной лаборатории с людьми, которые едва могли видеть своих микробов, потому что они были такими крошечными и росли так медленно. А Candida растет очень быстро, и под микроскопом она делает множество вещей», - говорит Гоу.
Гоу был особенно очарован клеточной стенкой грибка - динамичной слоистой структурой, созданной таким образом, что внутренний слой содержит консервативные структурные элементы, а внешний слой более изменчив и приспособлен к специфическим потребностям организма.
«Клеточная стенка - это для меня определяющая органелла грибка, - отметил он.
Поскольку она состоит из молекул, не встречающихся в человеческом организме, клеточная стенка грибка становится главной мишенью иммунной системы, в частности макрофагов, которые одними из первых иммунных клеток отправляются в бой с инвазивными грибками. Гоу и его коллеги попытались лучше понять взаимодействие между клеточной стенкой грибка и этими бойцами иммунной системы. Используя мутанты C. albicans, у которых отсутствовали компоненты биосинтеза маннанов - полимеров сахара маннозы, расположенных в самой внешней части клеточной стенки, они обнаружили, что такие мутанты чаще поглощаются макрофагами, чем грибки дикого типа, что позволяет предположить, что маннаны в клеточной стенке C. albicans помогают грибку уклоняться от этих иммунных клеток.
Маннаны в клеточной стенке грибка могут защищать другие молекулы во внутреннем слое структуры от иммунного обнаружения. Так обстоит дело с бета-глюканами, полисахаридами, которые являются патоген-ассоциированными молекулярными паттернами (PAMPs), вызывающими сильный иммунный ответ при обнаружении специфическими рецепторами макрофагов.Исследуя этот феномен маскировки маннанов у C. albicans, Гоу и его коллеги обнаружили, что истощение определенного типа маннанов, O-маннана, обнажает бета-глюканы на поверхности грибка, облегчая распознавание макрофагами и созревание фагосом внутри этой клетки врожденного иммунитета.
По словам Гоу, клеточная стенка грибка также очень хорошо регулируется и изменения в окружающей среде могут привести к перестройке ее структуры. В конкретном случае воздействия бета-глюкана Гоу и другие исследователи показали, что такие сигналы хозяина, как низкий уровень кислорода, воздействие кислой среды или лактата, которые представляют собой условия, в которых грибок может находиться в некоторых нишах человеческого организма, вызывают перестройку бета-глюкана. «[Клеточная стенка грибка] - это нечто, что постоянно следит за собой и изменяет себя, чтобы защитить себя от изменяющейся среды», - отметил Гоу.
Маннаны маскируют PAMPs от обнаружения макрофагами, но это не значит, что они невидимы для всех типов иммунных клеток. Моноциты, которые также привлекаются к месту инфекции, экспрессируют рецепторы распознавания образов, которые позволяют им обнаружить маннановый компонент клеточной стенки грибка. Загадка маннанового щита/активатора заинтриговала группу Гоу, которая исследовала эту проблему, используя четыре дрожжеподобных грибка, у которых отсутствовал фермент, важный для синтеза маннанов.
В то время как макрофаги демонстрировали повышенную реакцию на маннановые мутантные грибки, вероятно, за счет распознавания бета-глюканов, открытых в отсутствие маннановой оболочки, моноциты реагировали на эти мутанты слабо, что позволяет предположить, что маннаны являются иммунными агонистами для этих иммунных клеток. Изучение распознавания маннанов вплоть до молекулярного уровня является одной из нынешних целей Гоу. «Мы пытаемся выяснить, какой именно тип маннанов воспринимают иммунные рецепторы, распознающие маннаны, и пытаемся понять, почему существует так много различных классов рецепторов», - объясняет он.
Хотя Гоу и другие исследователи грибков неустанно пытаются найти эффективные способы профилактики и борьбы с грибковыми заболеваниями, он также признает, какую пользу людям приносят их взаимоотношения с этими организмами. «Каждый из нас использует грибковые продукты каждый день своей жизни. Они могут быть в хлебе, в ферментированных продуктах. Если у вас высокое кровяное давление, вы принимаете статины, а если у вас бактериальная инфекция, вы принимаете пенициллин», - отметил он. «Грибки - удивительные организмы, и мы пытаемся убить их только потому, что мы уязвимы перед ними, но мы все равно должны относиться к ним с благоговением, потому что они особенные».
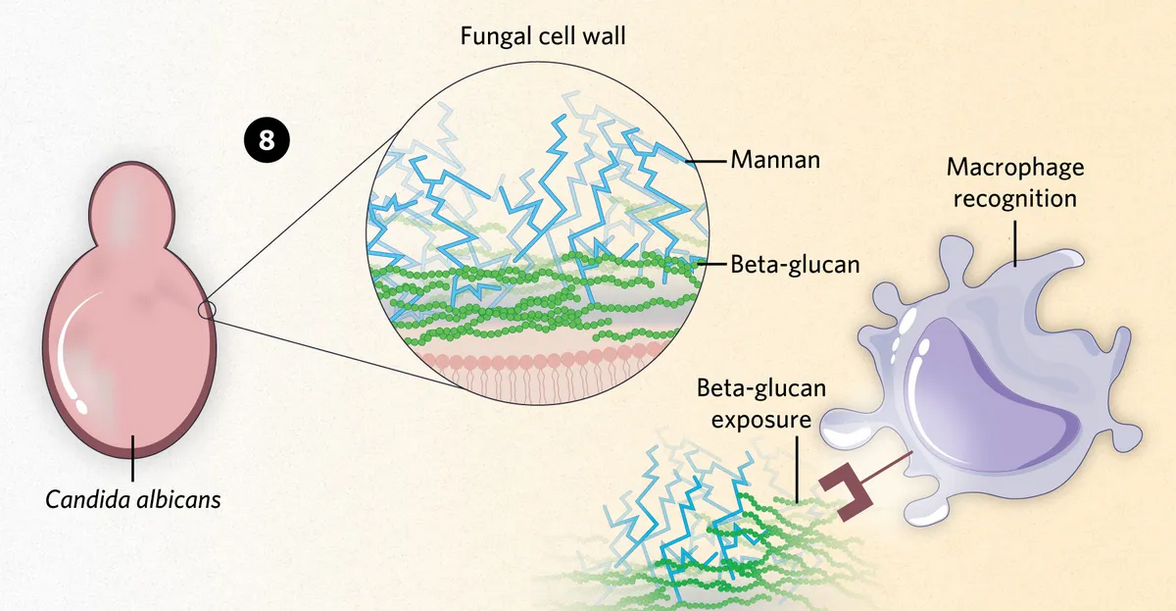
Модифицировано из © istock.com, ttsz, KKT Madhusanka.
8) У Candida albicans бета-глюканы являются основной мишенью для обнаружения макрофагами, которые являются одной из первых линий иммунной защиты. Грибок покрывает свои бета-глюканы слоем маннанов, защищая их от обнаружения макрофагами, чтобы продлить свое пребывание в организме хозяина.