Ученые начинают работать над тем, как микробиом кишечника может влиять на здоровье мозга. Это может привести к улучшению и упрощению лечения нейродегенеративных заболеваний.
В 2006 году, вскоре после открытия собственной лаборатории, нейробиолог Джейн Фостер из Университета МакМастера в Гамильтоне, Канада, обнаружила то, что, по ее мнению, должно было стать причиной напряженности в ее работе. Она и ее команда работали с двумя группами мышей: одна со здоровым кишечным микробиомом, другая без микробиома. Она заметила, что мыши без кишечных бактерий казались более спокойными. Когда их помещали в лабиринт с открытыми или обнесенными стенками дорожками, они предпочитали открытые дорожки. Отсутствие бактерий в кишечнике, казалось, влияло на их мозг и поведение.
Фостер написала исследование и представила его для публикации. Оно было отклонено. Она переписала его и снова разослала. Снова отказ. Наконец, после трёх лет и семи заявок статью приняли.
Джон Крайан, нейробиолог из Университетского колледжа Корк в Ирландии, поступил на работу примерно в то же время, что и Фостер, и точно знает, что она чувствовала. Когда он начал говорить о связях между бактериями, живущими в кишечнике и мозге, то "чувствовал себя юродивым", говорит он и вспоминает одну конференцию по болезни Альцгеймера, на которой он выступил в 2014 году. "Я никогда не выступал с докладом, к которому было бы еще меньше интереса".
Сегодня, однако, ось кишечник-мозг является популярной темой на крупных встречах неврологов, и Крайан говорит, что он больше не "этот сумасшедший парень из Ирландии". Тысячи публикаций за последнее десятилетие показали, что триллионы бактерий в кишечнике могут оказывать глубокое воздействие на мозг, и могут быть связаны с целым рядом заболеваний. Такие спонсоры, как Национальный институт здоровья США, вкладывают миллионы долларов в изучение этой связи.
Но вместе со взрывом интереса появилась и шумиха. Некоторые исследователи, занимающиеся исследованиями мозга, утверждают или подразумевают причинно-следственные связи, в то время как исследования показывают только некоторые корреляции, говорит Морин О'Мэлли из Сиднейского университета (Австралия). "Нашли ли вы реальную причину, или вы нашли просто еще один фактор?"
Однако в последние годы, по словам О'Мэлли, в этой области были достигнуты значительные успехи. Вместо того, чтобы говорить о микробиоме в целом, некоторые исследовательские группы приступили к поиску конкретных микроорганизмов, определяя сложные и порой удивительные пути, соединяющие их с мозгом. "Это то, что позволяет установить причинно-следственные связи", - говорит она. Исследования на мышах - и предварительная проверка на людях - показывают, что микробы могут вызывать или изменять течение таких состояний, как болезнь Паркинсона, расстройство аутистического спектра и многие другие. Терапии, направленные на совершенствование микробиома, могут помочь в профилактике или лечении этих заболеваний, и эта идея уже используется некоторыми исследователями и компаниями в клинических испытаниях на людях.
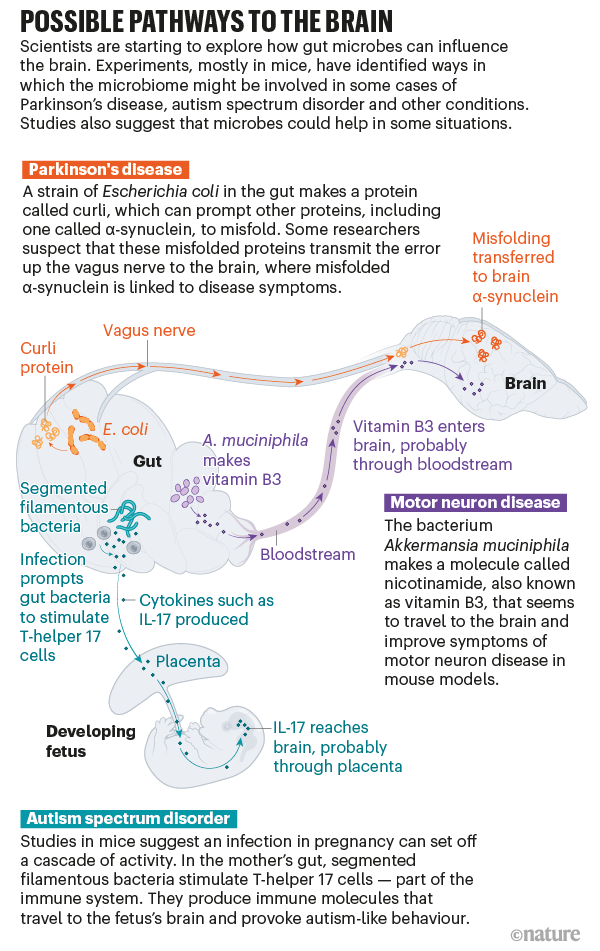
Рис. Nik Spencer/Nature
_______________________________________________________________________________________________________________________________________________________________________________________
Еще рано говорить, но перспективы новых методов лечения некоторых из этих трудноизлечимых заболеваний мозга захватывают, отмечает Саркис Мазманиан, микробиолог из Калифорнийского технологического института - особенно с учетом того, насколько легче манипулировать кишечником, чем мозгом. По его словам, внедрение терапии мозговых нарушений уже давно является сложной задачей, "но вы можете, черт возьми, изменить микробиом".
Распутывая клубок
В 1817 году английский хирург Джеймс Паркинсон описал первые случаи "трясущегося паралича", который стал известен как болезнь Паркинсона. У одного человека развилось онемение и колющие ощущения в обеих руках. Паркинсон заметил, что брюшная полость мужчины, похоже, содержала "значительное накопление". Он дал человеку слабительное, через десять дней его кишечник опустел, а симптомы исчезли. Некоторые люди, у которых развивается болезнь Паркинсона, страдают запорами задолго до того, как у них появятся проблемы с подвижностью. И многие исследователи приняли идею, что болезнь начинается в кишечнике, по крайней мере, в некоторых случаях.
Характерные симптомы болезни Паркинсона - тремор, скованность и медлительность движений - появляются по мере того, как нейроны, отвечающие за координацию движений, начинают умирать. Почему эти нейроны умирают не до конца понятно, но белок, известный как α-синуклин, похоже, играет ключевую роль. У людей, страдающих болезнью Паркинсона, белок неправильно упаковывается (misfolds.) Первый белок, упакованный с ошибками, вызывает еще больше ошибок упаковки, пока в мозгу не начнут образовываться вредоносные сгустки, известные как тела Леви.
Что запускает этот каскад? В 2015 году Роберт Фридланд, невролог из Университета Луисвилла в Кентукки, предложил новую теорию. Он прочитал, что кишечные бактерии могут вырабатывать белки, которые имеют структуру, схожую с неправильно сформированными α-синуклеиновыми белками, поэтому предположил, что бактериальные белки могут служить шаблоном для неправильного складывания. И когда он и его коллеги кормили крыс особым штаммом Escherichia coli, который производит в кишечнике один из этих слипающихся белков, называемый curli (кудряшки), они видели больше α-синуклеинов, накапливающихся в мозге животных. Работа, опубликованная в прошлом году Мазманианом и его командой, поддерживает теорию Фридланда.
Пока не ясно, как этот сигнал в кишечнике достигает мозга, но одним из вероятных каналов является блуждающий нерв. Блуждающий нерв соединяет ствол мозга со многими органами, включая толстую кишку, что делает его самым длинным из двенадцати черепных нервов, которые передают сигналы между мозгом и остальным телом. "Это действительно шоссе", - говорит Крайан. Исследования на людях и животных показывают, что он играет решающую роль в передаче, по крайней мере, некоторых сигналов между кишечником и мозгом.
В 1970-х годах обычной терапией язвы желудка было полное или частичное удаление нервов, чтобы обуздать выработку кислоты в желудке. Но в последние десятилетия исследователи заметили странный побочный эффект: люди, прошедшие эту процедуру, казалось, были менее восприимчивы к болезни Паркинсона.
При исследовании на мышах, введенный в кишечник неправильно упакованный α-синуклеин вырабатывается в мозге. Но если исследователи сначала удаляли блуждающий нерв, то α-синуклин в мозге не появляется. Сама инъекция α-синуклеина, похоже, остается в кишечнике, но Валина Доусон, нейробиолог из Университета Джона Хопкинса, которая была автором исследования, считает, что, возможно, существует эффект домино: плохо упакованные белки передают ошибку вверх по блуждающему нерву. Мазманиан и его коллеги сейчас проводят эксперименты, чтобы выяснить, может ли белок curli в кишечнике все еще вызывать симптомы Паркинсона у мышей, у которых блуждающий нерв был перерезан.
Поскольку неупакованные белки являются отличительной чертой некоторых других заболеваний, поражающих мозг, включая болезнь Альцгеймера и боковой амиотрофический склероз, или БАС, Фридланд говорит, что бактериальные белки могут быть причастны и к этим заболеваниям. Доусон находит эту идею правдоподобной, но говорит, что бактериальные амилоиды - не единственный фактор, который следует учитывать. Паркинсон, например, является сложным заболеванием, которое по-разному проявляется у разных людей. Тем не менее, она говорит, что "это может быть одним из способов начать исследовать все заново".
Сторонники кишечно-мозговой связи говорят, что микробиом может не только вызвать некоторые случаи нейродегенеративных заболеваний: он также может влиять на его тяжесть. Эран Элинав, иммунолог из Научного института Вайцмана в Реховоте, Израиль был поражен различиями в том, как может развиваться БАС: у некоторых людей болезнь прогрессирует медленно, у других состояние быстро ухудшается. Элинав задался вопросом, помогает ли микробиом объяснить эти различия, поэтому он и его группа начали работать с одной из самых распространенных моделей БАС на мышах. Когда они уничтожали микробиом антибиотиками или использовали мышей, у которых с рождения не было микробиома, они наблюдали гораздо более быстрое развитие болезни, чем у мышей с нормальным микробиомом.
Исследователи сравнили кишечные бактерии у БАС-мышей с бактериями у здоровых и обнаружили несколько видов микроорганизмов, которые, казалось были связаны с болезнью. Они кропотливо пересаживали эти виды, одного за другим, в другую группу мышей без каких-либо кишечных бактерий, выявив два вида, которые ухудшали симптомы БАС, и один, который, казалось бы, улучшал. "И тогда мы спросили себя: "Как этот штамм, который живет только в кишечнике, так удивительно воздействует на болезнь, которая фокусируется на мозге?", - рассказывает Элинав.
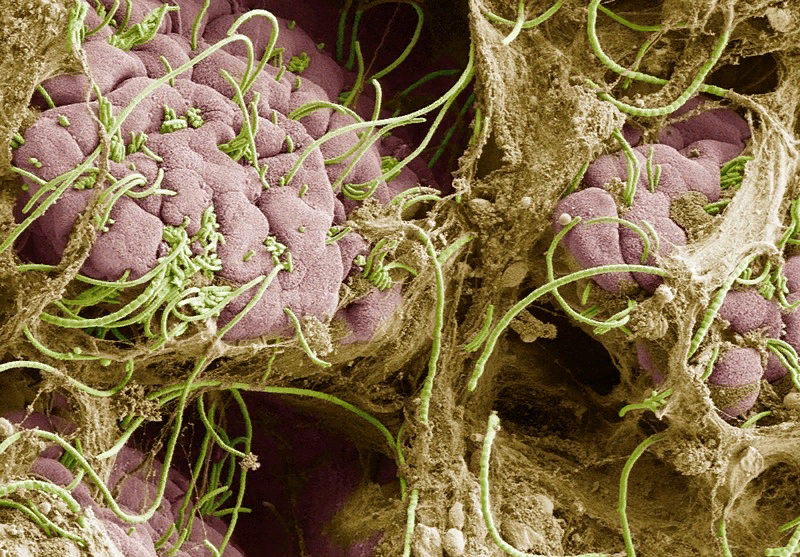
Сегментированные филаментные бактерии в кишечнике (зеленые) чрезмерно стимулируют иммунную систему инфицированных беременных мышей, изменяя развитие мозга плода. Фото: Dan Littman, Alice Liang, Doug Wei and Eric Roth
Виновными в этом могут быть метаболиты бактерий, которые могут попадать в кровоток.
По крайней мере половина всех метаболитов в крови "либо сделаны, либо модулированы микроорганизмами",
- говорит Элинав. Он и его сотрудники проанализировали метаболиты, вырабатываемые полезными микробами, и ввели одну молекулу - никотинамид, также известный как витамин В3, - мышам, склонным к БАС. Они обнаружили, что молекула попала в мозг и улучшила симптоматику. "Мы могли доказать, что есть бактерия, мы могли доказать, что есть продукт бактерии, и мы могли доказать, что она попала в нужный целевой орган и делала что-то благоприятное для течения болезни", - говорит он.
Когда они сравнили микробиомы людей с БАС и их незатронутых членов семьи, они увидели меньшее количество никотинамида у людей с БАС. Метаболит легко доступен в качестве добавки, и Элинав говорит, что он и его коллеги планируют провести с ним клинические испытания.
По крайней мере, одна группа уже протестировала витамин В3 в качестве препарата для лечения в небольшом исследовании, хотя и в комбинации с другим препаратом. Они вводили комбинацию участникам с БАС в течение четырех месяцев. Те, кто был в группе лечения показали некоторое улучшение, но почти у всех пациентов в группе плацебо состояние здоровья ухудшилось.
"Мы только начинаем", - говорит Элинав. Существует гораздо больше бактерий и метаболитов, и каждая клетка в организме открыта для их воздействия. Как только вы понимаете это, вы начинаете понимать, что эффект микробиома может распространиться далеко за пределы того места, где микробы на самом деле обитают".
Эффекты, передаваемые следующему поколению
Эффект может даже передаваться из поколения в поколение. Возьмите расстройство аутистического спектра (ASD). Причины аутизма до сих пор плохо изучены, но, согласно эпидемиологическим исследованиям, инфекции у матери во время беременности, по-видимому, повышают риск развития аутизма у ребенка. Например, в шведской когорте, насчитывающей почти 1,8 миллиона человек, у тех, чьи матери были госпитализированы по поводу любой инфекции во время беременности, риск диагноза аутизма был на 79% выше.
Исследования на мышах также подтверждают наличие этой связи. Чтобы имитировать инфекцию, исследователи вводят беременным мышам двухцепочечную РНК, которую организм воспринимает как вирусного захватчика. Их детёныши демонстрируют большую тревожность, чем те, которые родились у матерей, которым не вводили РНК, и они меньше взаимодействуют с другими мышами - симптомы, которые зеркально отражают симптомы людей с ASD.
Глория Чой, нейробиолог Массачусетского технологического института, хотела понять почему. Она начала с Т-хелперов 17, производящих цитокины. Когда она имитировала у мышей инфекцию, эти клетки становились гиперактивными, вырабатывая IL-17. Эта молекула проникала в мозг развивающихся детенышей, вероятно, через плаценту, а затем связывалась с рецепторами мозга. Это, похоже, оказывало сильное воздействие на животных: исследователи обнаружили, что у взрослого потомства повысилась нейрональная активность, что привело к их аутистическому поведению.
Но "не у каждой беременной женщины, которая инфицирована или госпитализирована во время беременности, обязательно есть дети с нарушениями нейроразвития или аутизмом", - говорит Хью. Должно быть что-то, что подталкивает иммунную систему матери к этому гиперактивному состоянию. Чой сосредоточилась на коллекции микробов тонкого кишечника, известных как сегментированные филаментные бактерии, которые, как было показано ранее, способствуют образованию Т-хелперов 17. Когда она лечила беременных мышей антибиотиками, чтобы убить этих бактерий, а затем стимулировала иммунную реакцию, у детенышей не развивались поведенческие различия.
Чой хотела бы понять, может ли коронавирусная пандемия привести к повышенному риску развития ASD, поэтому она собирает образцы у беременных женщин, инфицированных SARS-CoV-2, каталогизирует бактерии их кишечника и определяет уровень IL-17 в их крови. Учитывая, что коронавирус, как и любая другая инфекция, активирует иммунную систему матери, вполне вероятно, что SARS-CoV-2 может увеличить риск измененного развития мозга и потенциальных психических расстройств у плода, говорит Дэвид Амарал, который изучает ASD в Университете Калифорнии. Но исследователи пока не нашли доказательств в поддержку этой теории.
Мауро Коста-Маттиоли, нейробиолог из медицинского колледжа Бэйлор в Хьюстоне, также изучает связь между бактериями и ASD. Но вместо того, чтобы смотреть на бактерии, которые вызывают это заболевание, он нашел одну, которая может лечить его симптомы.
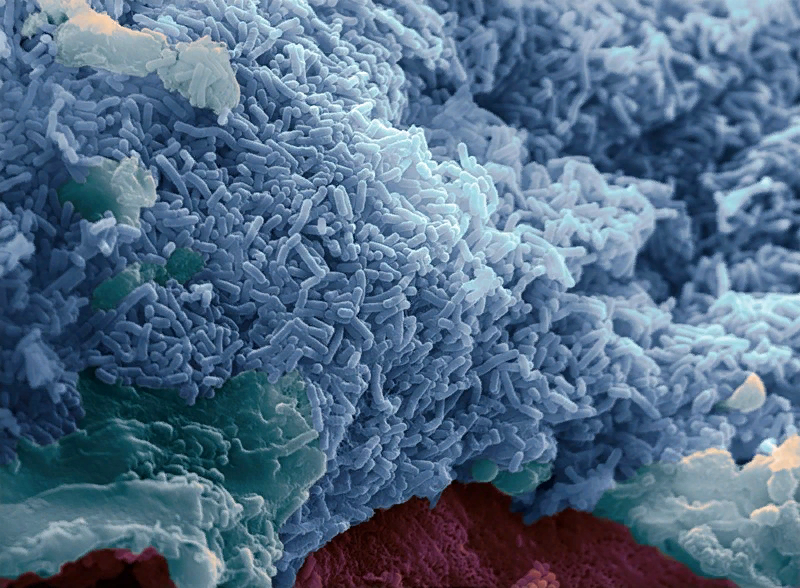
Бактерия кишечника Lactobacillus reuteri исследуется на предмет лечения симптомов расстройства аутистического спектра. Фото: Stephanie Schuller/Alistair Walsham/SPL
Коста-Маттиоли случайно наткнулся на эту бактерию около пяти лет назад. В то время он работал с мышином потомством, у которого были симптомы, похожие на аутизм. Когда эти мыши размещались вместо со здоровыми (и ели их экскременты, как и все мыши), их поведение, похожее на аутизм, исчезало. Коста-Маттиоли и его коллеги выяснили, что у больных мышей не хватает определенного вида бактерий: Lactobacillus reuteri.
Они протестировали L. reuteri в нескольких других мышиных моделях, и бактерия смогла обратить вспять некоторые ASD-подобные поведения в каждой из них. И, как и в работе по болезни Паркинсона, исследователи могли заблокировать эффект у мышей, если перерезали блуждающий нерв.
Какой именно сигнал посылает L. reuteri, пока неизвестно. Группа обнаружила, что некоторые штаммы L. reuteri могут изменить поведение, в то время как другие не могут, и в настоящее время исследователи работают над тем, чтобы выяснить, какой из ее генов важен. Если они найдут ген, который вырабатывает ключевой метаболит, "мы можем просто поместить его в любую бактерию, и получить потенциальный терапевтический препарат", говорит Коста-Маттиоли. Однако эта стратегия еще не апробирована.
Другая исследовательская группа в Италии уже испытывает L. reuteri в качестве терапии у 80 детей с ASD. Участники будут принимать L. reuteri или таблетку плацебо в течение шести месяцев, и их симптомы будут отслеживаться. Коста-Маттиоли надеется вскоре начать собственное исследование.
Будет ли это работать, еще предстоит увидеть, но Кевин Митчелл, нейрогенетик из Тринити-колледжа в Дублине, пока не находит убедительными исследования на мышах. И он считает обсуждение терапевтического потенциала преждевременным и "немного безответственным", по его словам, учитывая сложность заболевания.
Между тем, исследователи изучают все больше недугов мозга, включая болезнь Альцгеймера и депрессию. Микробы кишечника могут даже влиять на то, как мозг восстанавливается после травмы. Коринн Бенакис, нейробиолог из Института по изучению инсульта и слабоумия при Мюнхенском университете Людвига Максимилиана в Германии, и ее коллеги лечили мышей антибиотиками, чтобы избавиться от некоторых бактерий кишечника перед тем, как индуцировать инсульт. Они обнаружили, что антибиотики могут уменьшить тяжесть повреждения мозга.
По каждой из этих болезней остается множество вопросов. Исследователи в этой области признают, что им еще предстоит пройти путь от бактерии до мозга. И самым трудным шагом будет проверка моделей на людях и переход к испытаниям.
"Это экстраординарные притязания, которые должны потребовать экстраординарных доказательств", - говорит Митчелл.
Но есть и огромный интерес - и не только со стороны учёных. В феврале 2019 года компания Axial Therapeutics, соучредитель которой Мазманиан разработал методы лечения нейродегенеративных и психоневрологических заболеваний, собрала 25 миллионов долларов США. Другая компания, Finch Therapeutics, которая разрабатывает пероральный микробиомный препарат для лечения ASD, объявила в сентябре, что она собрала 90 миллионов долларов.
Крайан наблюдал за данными с тех пор, как его разговор на эту тему был встречен каменным молчанием. Он находит растущие доказательства убедительными и видит огромные перспективы в микробиомных терапиях. "В отличие от твоего генома, с которым ты не можешь ничего поделать, кроме как обвинять родителей, бабушек и дедушек, твой микробиом потенциально может быть модифицирован". И это дает большую свободу действий", - говорит он. "Это действительно захватывающе".
