Когда микробиом кишечника самцов мышей нарушается, это повышает риск развития заболеваний у их потомства. Это говорит о том, что состояние здоровья отцов до зачатия может влиять на здоровье будущего поколения.
Микробиом играет важную роль в здоровье хозяина, распространяя свое влияние на его потомство. Исследования на мышах показали, что материнские кишечные бактерии могут влиять на поведение потомства и рост плаценты во время беременности. Однако влияние отцовского микробиома на здоровье их потомства оставалось относительно неизученным.
В недавнем исследовании, опубликованном в журнале Nature, ученые обнаружили, что изменение микробиома кишечника самцов мышей негативно сказывается на здоровье и продолжительности жизни их потомства. Это происходило за счет эпигенетических изменений в сперме. Полученные результаты проливают свет на ось «кишечник - половые клетки», которая транслирует влияние микробиома на здоровье и болезни из поколения в поколение.
Айеле Аргау-Денбоба, биолог по репродуктивному развитию из Института иммунобиологии и эпигенетики Макса Планка, был одним из соавторов исследования. По его мнению, микробиом может влиять практически на все системы органов, но его воздействие на репродуктивную систему изучено недостаточно хорошо. «Когда мы начинали проект, мы предположили, что влияние на репродуктивную систему может распространяться на следующее поколение», - сказал он.
Чтобы изучить влияние отцовского микробиома на здоровье потомства, исследователи подвергли самцов мышей воздействию антибиотиков или слабительных средств, чтобы вызвать дисбаланс микроорганизмов в кишечнике, или дисбиоз. Затем они спарили этих мышей с самками, имеющими здоровый микробиом. Изучив сотни полученных детенышей, как самцов, так и самок, они обнаружили, что они имели меньший вес при рождении и чаще умирали преждевременно по сравнению с потомством отцов с нормальным микробиомом. Масса тела детенышей оставалась значительно ниже на протяжении всего развития, а транскрипционный анализ клеток мозга и жировой ткани выявил различия в нескольких генах, связанных с метаболическими процессами, между потомством контрольных и дисбиотических мышей.
Исследователи также показали, что отцовский микробиом восстанавливается в течение восьми недель после прекращения антибиотикотерапии. Потомство, зачатое после этого восстановления, было здоровым, что свидетельствует о кратковременности эффекта дисбактериоза. Микробиота кишечника потомства не была нарушена, что говорит о том, что измененный отцовский микробиом не передался детенышам. Далее исследователи выяснили, передается ли влияние нарушенной микробиоты кишечника следующему поколению через сперму отцов. Оплодотворение in vitro с использованием спермы, выделенной из обработанных антибиотиками мышей, показало, что потомство имело меньший вес при рождении и нарушенное развитие, что свидетельствует о наличии оси кишечник-половые клетки, влияющей на здоровье потомства. Дальнейшие эксперименты показали, что в сперме мышей с дисбиозом было меньше некоторых малых РНК, что позволило предположить участие этих эпигенетических факторов - тех, которые не изменяют последовательность ДНК, но могут влиять на экспрессию генов - в передаче признаков от поколения к поколению.
Узнав, что сперматозоиды передают потомству эпигенетическую информацию, исследователи задались вопросом, как дисбактериоз влияет на репродуктивную систему отцов. Они заметили, что у мышей с нарушенным микробиомом яички были значительно меньше, а количество сперматозоидов ниже, чем у здоровых мышей. Метаболическое профилирование тестикул показало, что дисбиоз микробиома изменил метаболитный ландшафт, в частности метаболиты, участвующие в функционировании половых клеток, и уровень лептина, гормона, необходимого для поддержания репродуктивной функции. Транскриптомный анализ подтвердил, что измененный микробиом вызвал дисрегуляцию экспрессии генов лептина, что делает лептиновую сигнализацию ключевым компонентом оси «кишечник - половые клетки».
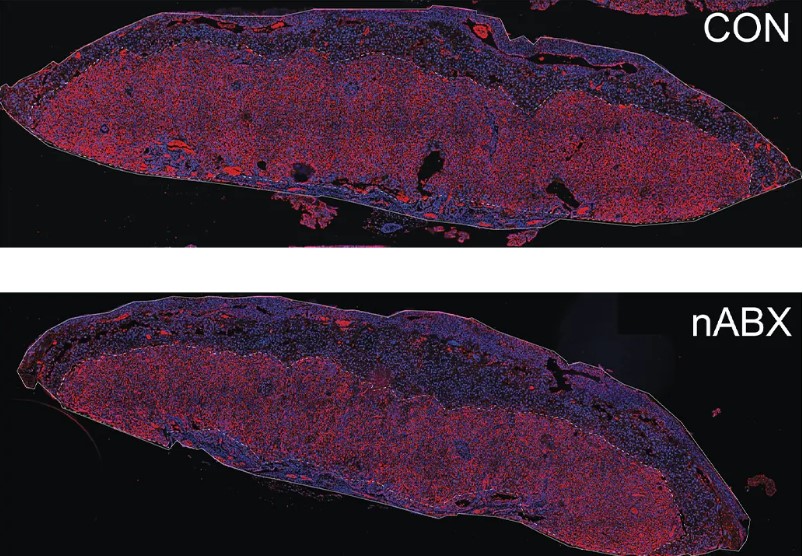
Чтобы точно определить первоначальный источник дефектов в потомстве, исследователи проанализировали транскриптомы эмбрионов на половине срока беременности. Не обнаружив различий в экспрессии генов между эмбрионами, полученными от здоровых и дисбиотических мышей, они перешли к изучению плаценты на том же сроке беременности. Это позволило выявить значительные различия в зависимости от отцовского микробиома. Плаценты эмбрионов мышей, получавших антибиотики, имели меньшую площадь для обмена питательными веществами, меньшее количество кровеносных сосудов и меньшее кровоснабжение по сравнению с плацентами эмбрионов здоровых отцов, что указывает на более высокий риск плацентарной недостаточности.
«Мы не были очень удивлены полученными результатами, - говорит Аргау-Денбоба, - отчасти потому, что предыдущие исследования показали, что отцовский стресс и диета могут влиять на потомство. «Но [это] было очень интересно, поскольку исследование является первым, напрямую связывающим микробиоту кишечника будущих отцов со здоровьем их потомства». По признанию Аргау-Денбоба, в ходе исследования не было выяснено, какие именно виды микроорганизмов вовлечены в ось «кишечник - зародыш», но лаборатория продолжает работу над этим вопросом.
Оливер Рэндо, изучающий эпигенетическое наследование отцовских признаков в Медицинской школе Массачусетского университета, говорит, что исследование было тщательным и убедительным, в том числе благодаря большому количеству использованных животных. Он считает впечатляющим тот факт, что восстановление микробиоты у будущих отцов улучшило здоровье потомства. Это означает, что на самом деле отцы «рассказывают» своим детям о вещах, которые гораздо более актуальны в данный момент, что весьма удивительно», - сказал он. «Это действительно заставило меня изменить свое представление о собственной области». Однако, добавил он, исследование не выявило точных молекулярных изменений в сперме, которые влияют на здоровье потомства. Хотя Рэндо полагает, что полученные результаты будут справедливы и для людей, он не уверен в этом, в частности, из-за различий в природе плацент человека и мыши.
Аргау-Денбоба высказал аналогичные мысли и предупредил, что результаты, полученные на мышах, не обязательно будут применимы к людям. Но если применимы, то, по его мнению, выявление микроорганизмов, участвующих в процессе, может стать диагностическим маркером для прогнозирования или основой для новых терапевтических стратегий, направленных на предотвращение неблагоприятных исходов беременности.