Исследователи превратили программируемые белки в новый генетический инструмент, потенциально позволяющий более жестко контролировать экспрессию генов.
Хотя CRISPR, возможно, является самой известной генетической технологией, появившейся благодаря микробам, исследователи заимствуют из бактериальных систем множество других методов контроля генов и их продуктов. Один из них - оперон lac, который регулирует экспрессию генов, участвующих в метаболизме лактозы у Escherichia coli. Его используют для избирательного включения экспрессии генов - от лабораторного стола до промышленных чанов.
Однако в большинстве случаев исследователи заимствуют лишь часть системы оперона lac. Они используют репрессорный белок LacI, который физически связывает ДНК перед промотором гена и блокирует РНК-полимеразу, а затем добавляют молекулу индуктора, которая удаляет LacI, когда исследователи хотят включить экспрессию гена. Хотя эта система регулирует экспрессию генов, для их постоянного подавления требуются высокие концентрации LacI.1 Для сравнения, полная форма оперона, которая встречается в E. coli, включает дополнительные сайты связывания LacI, которые образуют петлю ДНК, более эффективно подавляя транскрипцию генов lac-оперона с использованием меньшего количества репрессорного белка.
Одна из исследовательских групп заинтересована в использовании этой особенности для разработки нового подхода к регуляции генов. В статье, опубликованной в журнале Nucleic Acids Research, ученые из клиники Майо создали новый белок, который имитирует двойную связывающую способность LacI, предлагая новый подход к регуляции экспрессии генов в будущем.
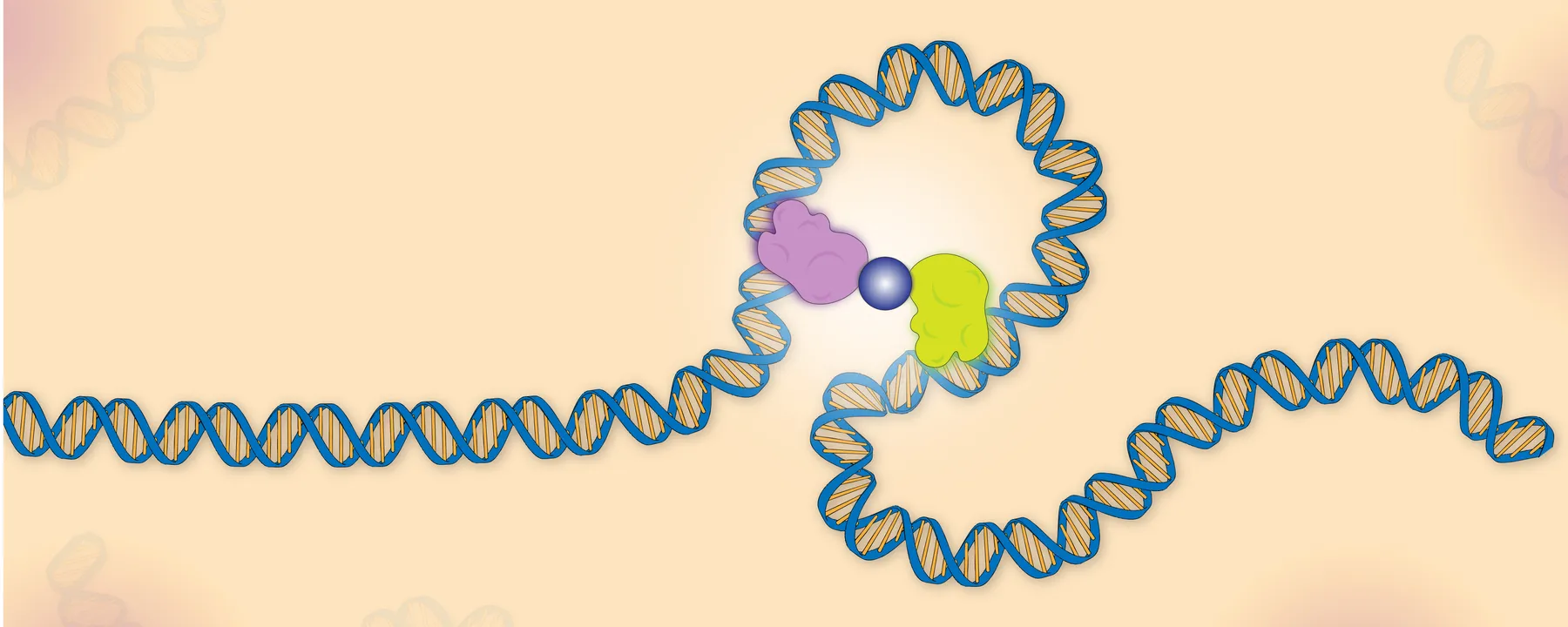
LacI - тетрамерный белок, использующий два димера для связывания двух специфических, идентичных последовательностей ДНК. Такая специфичность сужает возможности использования системы LacI в случаях, когда исследователи не могут вставить эту последовательность, что подтолкнуло к поиску более гибкого репрессорного белка, способного распознавать больше участков ДНК. «Примерно в 2015 году мы начали работать над идеей создания дизайнерской петли репрессии генов», - рассказала Николь Беккер, молекулярный биолог из клиники Майо и соавтор исследования.
Белки TALE, сокращенно от transcription activator-like effector, - это класс белков, полученных от патогенов растений рода Xanthomonas. Белки TALE распознают ДНК с помощью повторяющегося ряда из 34 аминокислотных областей, в которых 12-я и 13-я аминокислоты определяют нуклеиновую кислоту, с которой будет связываться каждый сегмент. Патогены используют эти белки для активации экспрессии генов в растениях, что способствует выживанию бактерий, но ученые взломали этот ДНК-связывающий код, чтобы создать собственные TALE, которые могут распознавать любую последовательность на которую они хотят нацелиться.
В данном исследовании ученые скопировали двуглавую природу LacI, соединив вместе два разных димера TALE, названных A и O2, которые распознают разные последовательности ДНК. Они вставили эти две последовательности перед репортерным геном и использовали колориметрический анализ, чтобы определить, подавляют ли белки экспрессию репортера. Их целью было определить параметры, необходимые для достижения репрессии гена, сравнимой с LacI.
Во-первых, исследователи оценили влияние порядка расположения двух димеров TALE в белке на эффективность репрессии. Предыдущие эксперименты показали, что размещение более сильного репрессора дальше от промотора улучшает репрессию, поэтому они проверили степень репрессии A и O2. Затем они вставили последовательность для более сильного TALE A в дистальный участок промотора, а более слабого TALE O2 - ближе к стартовой последовательности. Авторы изучили оптимальные параметры димера с помощью математического моделирования связывания и репрессии белков. Они определили, что конструкция димера с TALE A в качестве первого TALE в аминокислотной последовательности и TALE O2 в качестве второго создает более репрессивный димер, чем в обратном случае.
Наконец, исследователи сравнили репрессию димера TALE с LacI. Ковалентный димер TALE оказался сопоставимым с LacI, что подтверждается моделированием. «Именно тогда нас заинтриговало, что мы можем искусственно создать нечто, способное создать такую же сильную петлю ДНК, как и в системе репрессора lac», - рассказывает Беккер.
«Это очень умное применение TALE», - считает Адам Богданов, молекулярный патолог растений из Корнельского университета, не принимавший участия в исследовании. Группа Богданова была одной из тех, кто первоначально описал код последовательности TALE. По его словам, экспериментальная и модельная работа - это хороший подход к оптимизации белков и изучению их функций. «Это еще один мощный инструмент в арсенале средств, позволяющих регулировать экспрессию генов или манипулировать ею для понимания их функций», - сказал он. По мнению Богданова, в будущем было бы интересно сравнить, насколько эффективно димеры TALE подавляют экспрессию генов по сравнению с системами интерференции CRISPR. Кроме того, он отметил, что усовершенствование димерной системы для регуляции степени репрессии поможет расширить ее применение.
Беккер и ее коллеги также заинтересованы в поиске способов сделать систему настраиваемой, а также в ее изучении на эукариотических моделях. В отличие от LacI, белки TALE можно заставить распознавать любую последовательность. Она пояснила, что ее группа будет использовать выявленные параметры для проверки механизма репрессии димера TALE на новых участках ДНК у бактерий и эукариот.