Когда нити ДНК сплетаются и расплетаются в замысловатом танце, то на первый план выходит одно важное событие - репликация.
Этот процесс необходим для жизни, но тонкости оркестровки его этапов до сих пор не раскрыты. Во время репликации концы линейной ДНК не могут полностью повториться, что приводит к укорачиванию теломер - известное явление, называемое "проблемой концевой репликации".
Преемственность генетического материала в поколениях клеток и организмов обеспечивается процессом репликации – удвоения молекул ДНК. В результате этого сложного процесса, осуществляемого комплексом нескольких ферментов и не обладающих каталитической активностью белков, необходимых для придания полинуклеотидным цепям нужной конформации, образуются две идентичные двойные спирали ДНК. Эти так называемые “дочерние” молекулы ничем не отличаются друг от друга и от исходной “материнской” молекулы ДНК. Репликация происходит в клетке перед делением, поэтому каждая дочерняя клетка получает точно такие же молекулы ДНК, какие имела материнская клетка.
“Проблема концевой репликации” заключается в том, что все известные ДНК-полимеразы, являющиеся ключевыми ферментами сложного репликативного белкового комплекса, неспособны полностью реплицировать концы линейных молекул ДНК. Для того чтобы клетки не теряли при делении часть генетического материала, 3'-концы ДНК хромосом эукариот наращиваются перед каждым раундом репликации короткими повторяющимися последовательностями. Это осуществляется ферментами – теломеразами.
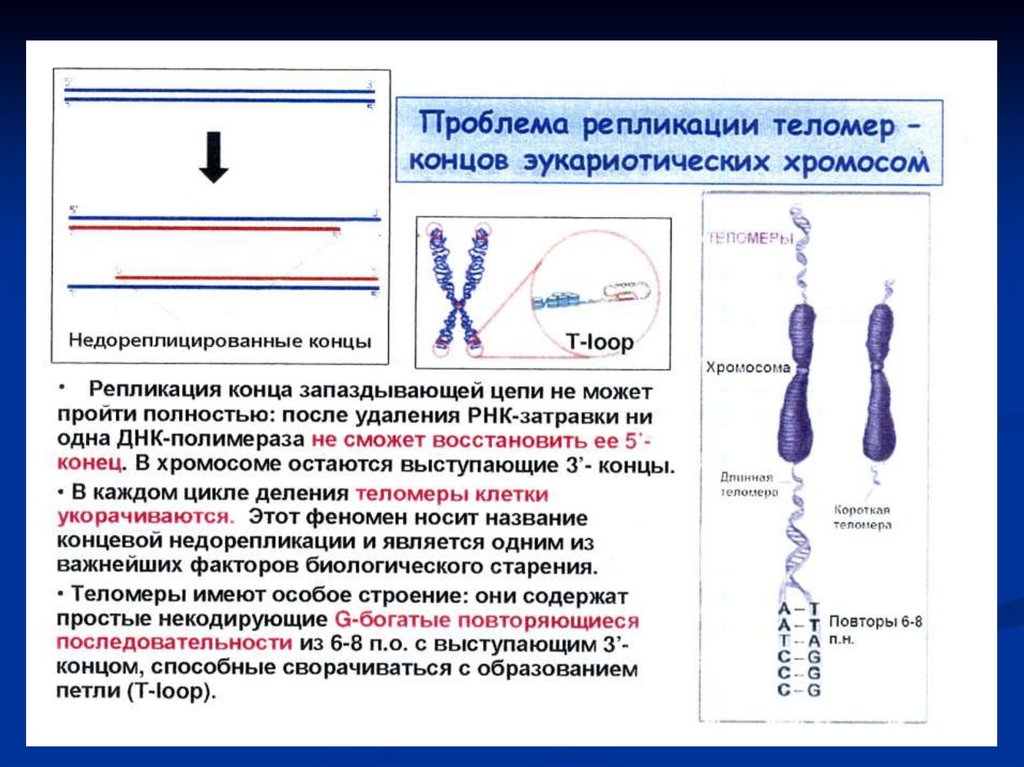
Открытие теломеразы в 1980-х годах, казалось, решило эту проблему. Теломераза естественного происхождения добавляла одноцепочечные G-богатые повторы TTAGGG к концам теломер. Однако Тиция де Ланге, клеточный биолог и генетик из Рокфеллеровского университета, и ее сотрудники поняли, что это лишь часть решения. Результаты их исследований, опубликованные недавно в журнале Nature, показали, что в то время как теломераза решает проблему репликации концов на ведущей нити, другой комплекс работает в тандеме на отстающей нити. Это позволяет понять биологию теломер в здоровье и заболеваниях.
Хироюки Такаи, клеточный биолог и генетик из группы де Ланге, сделал неожиданное открытие, изучая отстающую нить в клетках, в которых отсутствовал молекулярный комплекс, состоящий из группы белков CTC1-STN1-TEN1 (CST), связанных с полимеразой α-праймазой (Polα-праймазой). CST-Polα-праймаза - это аналог теломеразы на отстающей нити, который добавляет богатые С-повторами CCCTAA на концы теломер. Однако когда Такаи исследовал теломеры в клетках, лишенных гена CTC1, который отключает CST-Polα-праймазу, он получил гель, который не соответствовал установленной модели. Ожидаемый синтез заполнителя был неполным. «Регулярная репликация теломер должна была идти в ногу с теломеразой и удлиняться во время репликации ДНК, но было ясно, что это не так», - говорит де Ланге.
В экспериментах Такаи репликация ДНК протекала так, что синтез ведущей нити создавал тупой конец, а теломераза удлиняла нить G, как и ожидалось. Однако синтез богатой нити С с помощью коротких фрагментов ДНК (фрагментов Оказаки) в этих клетках, как ни странно, не происходил. «Она не только не удлинялась, но и становилась короче», - говорит де Ланге.
Фрагменты Оказаки — относительно короткие фрагменты ДНК (с РНК-праймером на 5'-конце), которые образуются на отстающей цепи в процессе репликации ДНК. Длина фрагментов Оказаки у E. coli составляет около 1000—2000 нуклеотидов, а у эукариот — обычно 100—200 нуклеотидов. Фрагменты Оказаки были описаны в 1968 году Рэйдзи Окадзаки, Цунэко Окадзаки и их соавторами при изучении репликации ДНК бактериофага у кишечной палочки.
Обычно на отстающей нити синтез ДНК идет беспрепятственно и реплисома начинает синтезировать последние фрагменты Оказаки вдоль 3' петли, которые впоследствии сшиваются вместе, чтобы предотвратить потерю последовательности. Однако никто не знал, что именно происходит с реплисомой, когда она достигает конца ДНК. Поскольку выводы Такаи предполагали, что реплисома не доходит до последнего фрагмента Оказаки и приводит к недостаточному синтезу праймера вдоль отстающей нити, это заслуживало изучения. Озадаченная, де Ланге обратилась к молекулярному биологу Джозефу Йелесу с просьбой повнимательнее присмотреться к реплисоме во время этого события.
Чтобы изучить репликацию ДНК in vitro, Йелес собрал реплисомы из белков Saccharomyces cerevisiae, способных осуществлять полную репликацию ведущей и отстающей нитей. Он заметил, что реплисомы инициировали фрагменты Оказаки в пределах 150-200 нуклеотидов от концов шаблонов, но останавливались примерно в 20 нуклеотидах от концов шаблонов ведущих нитей. «[Реплисома] просто не может этого сделать. Она не может поставить ногу на последний кусочек ДНК, прежде чем отвалится", - замечает де Ланге. Это укорочение теломер на отстающем конце подтверждает существование второй проблемы концевой репликации.
Такаи попытался подтвердить выводы Йелеса в естественных условиях. Предыдущие работы команды де Ланге и других исследовали эффект отключения CST-Polα-праймазы, однако скорость и причина укорочения теломерных участков оставались неясными. Такаи выделил и измерил потерю последовательностей на ведущем и запаздывающем концах теломер в клетках, в которых отсутствовал CTC1. Используя градиент хлорида цезия, Такаи получил результаты, которые повторяли анализ Йелеса in vitro: нить G росла, а нить C укорачивалась. Это усиливало неспособность отстающей нити достичь той же длины, что и ее аналог.
Теломераза предотвращала укорачивание лидирующей нити, а CST-Polα-праймаза решала ту же проблему на отстающей нити. Комплекс CST-Polα-праймаза противодействовал потере примерно 76 нуклеотидов в С-нити, что указывает на его роль в биологии теломер. «Это исследование выявило второй механизм поддержания теломер», - считает Си Джи Лим, молекулярный клеточный биолог из Университета Висконсин-Мэдисон, который не принимал участия в исследовании. «Это переломный момент, который позволяет взглянуть с высоты птичьего полета и оценить не только теломеразу, но и другие менее известные белки, такие как CST-Polα-праймаза». «Это замечательно для данной области, потому что есть основа, на которой исследователи могут заполнить молекулярные детали. Так что я ожидаю, что в будущем мы узнаем гораздо больше о заполнении нити C", - заметил Лим.
Де Ланге и ее группа намерены продолжить изучение структурной биологии ключевых регуляторов теломеразы и определить киназу, критическую для репликации концов. Они надеются, что эти результаты также позволят понять клинические последствия для людей с нарушениями теломер.

