Методы, подобные CRISPR, позволяющие изменять последовательность ДНК, все ближе продвигаются к клинике в качестве лечения некоторых генетических заболеваний.
Но за пределами CRISPR, как центра внимания, исследователей все больше привлекает альтернатива, которая оставляет последовательности ДНК неизменными. Эти молекулярные инструменты нацелены на эпигеном - химические метки, покрывающие ДНК и окружающие ее белки, которые управляют экспрессией гена и его поведением.
Шквал исследований, проведенных в последние несколько лет на мышах, свидетельствует о том, что редактирование эпигенома является потенциально более безопасным и гибким способом включения или выключения генов, чем редактирование ДНК. В одном из примеров, описанном в прошлом месяце на конференции по генной терапии в Вашингтоне, группа итальянских ученых уменьшила экспрессию гена у мышей, чтобы снизить уровень холестерина у животных на несколько месяцев. Другие группы исследуют редактирование эпигенома для лечения всего - от рака до болевого синдрома и болезни Хантингтона, смертельного расстройства головного мозга.
В отличие от редактирования ДНК, где изменения являются постоянными и могут привести к непредвиденным результатам, эпигеномные изменения могут с меньшей вероятностью вызвать вредные побочные эффекты и могут быть обратимы. Они также могут быть более тонкими, слегка повышая или понижая активность гена, а не разгоняя его на полную мощность или полностью удаляя. "Самое интересное, что с помощью этой технологии можно сделать очень много разных вещей, - говорит давний исследователь редактирования эпигенома Чарльз Герсбах из Университета Дьюка.
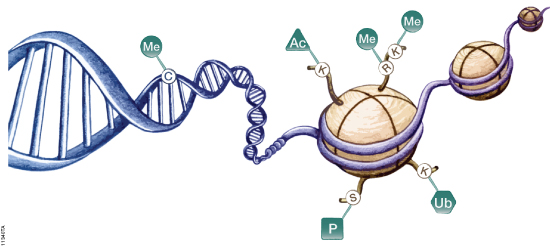
Добавление или удаление химических меток на ДНК и белков гистонов, вокруг которых она наматывается, может либо заглушить ген, либо раскрыть его последовательность оснований ДНК для других белков, которые включают его. Некоторые противораковые препараты удаляют или добавляют эти химические метки, но как средства борьбы с заболеваниями они имеют незначительный успех. Одна из проблем заключается в том, что эти препараты не сфокусированы, они действуют на многие гены одновременно, а не только на те, которые ассоциируются с раком, что означает, что они имеют токсичные побочные эффекты.
Но редактирование эпигенома можно сделать точным, используя те же ферменты, которые клетки используют для включения и выключения своих генов. Исследователи присоединяют ключевые компоненты этих белков к белку, редактирующему гены, например, к "мертвой" версии белка Cas9 CRISPR, способного нацеливаться на определенное место в геноме, но не способного разрезать ДНК. Их действие может быть различным: один редактор может удалять метки с гистонов, чтобы включить ген, а другой может добавлять метильные группы в ДНК, чтобы его заблокировать.
Два десятилетия назад биотехнологическая компания Sangamo Therapeutics с помощью этого метода разработала редактор эпигенома, который включал ген VEGF, способствующий росту кровеносных сосудов, в надежде восстановить кровоток у людей с нейропатией, вызванной диабетом. Компания ввела ДНК, кодирующую редактор, в мышцы ног около 70 пациентов в ходе клинических испытаний, но лечение не дало положительных результатов. "Мы не смогли эффективно доставить его в мышечную ткань", - говорит Федор Урнов, бывший специалист компании Sangamo, ныне работающий в Институте инновационной геномики при Калифорнийском университете.
Поэтому компания выбрала адено-ассоциированный вирус (AAV) - безвредный вирус, давно используемый в генной терапии для эффективной доставки ДНК в клетки. По идее, механизм производства белка в клетке будет использовать ДНК, кодирующую редактор эпигенома, чтобы обеспечить его постоянное снабжение. Эта стратегия выглядит все более обнадеживающей: за последние 3 года компания Sangamo сообщила, что у мышей она может снизить уровень тау, белка, участвующего в развитии болезни Альцгеймера, а также уровень белка, вызывающего болезнь Хантингтона.
Другие группы, работающие с мышами, используют метод доставки AAV для повышения аномально низких уровней белка для лечения наследственной формы ожирения, а также синдрома Драве, тяжелой формы эпилепсии. В прошлом году одна группа использовала эпигеномное редактирование для отключения гена, участвующего в восприятии боли, на несколько месяцев, что является потенциальной альтернативой опиоидным препаратам. Другая группа недавно включила ген с помощью редактора эпигенома, доставленного вирусом, отличным от AAV. Они ввели его молодым крысам, подвергавшимся воздействию алкоголя; алкоголь заглушал активность гена, что, в свою очередь, вызывало у животных тревогу и склонность к выпивке. Редактор эпигенома вновь пробудил ген и снял симптомы, сообщила эта группа в мае в журнале Science Advances.
При редактировании эпигенома инструмент редактирования генов, такой как "мертвая" версия белка Cas9 CRISPR, нацеливается на ген. Затем присоединенный белок-эффектор добавляет или удаляет химические метки на ДНК и белках гистонов, вокруг которых он наматывается, повышая или понижая активность гена. AAV, тестируемые многими группами, стоят дорого, и эти носители ДНК вместе с чужеродными белками, которые они кодируют, могут вызвать иммунный ответ. Другой недостаток заключается в том, что петля ДНК, кодирующая редактор эпигенома, постепенно теряется в клетках при их делении.
В прошлом месяце на ежегодной встрече Американского общества генной и клеточной терапии в Вашингтоне эксперты по редактированию генов предложили альтернативу, позволяющую избежать недостатков AAVs. Ключевой шаг для группы, возглавляемой Анджело Ломбардо из Института генной терапии, был сделан в 2016 году, когда он, Луиджи Налдини и другие сообщили в журнале Cell, что добавление коктейля из трех различных редакторов эпигенома к клеткам подавляет экспрессию генов, и это сохраняется, когда клетки делятся.
Это означает, что вместо того, чтобы использовать AAVs для переправки ДНК для редакторов эпигенома и заставлять их бесконечно экспрессироваться, можно использовать липидные наночастицы, своего рода жировые пузырьки, для переноса их кода в виде мессенджерной РНК (мРНК). Таким образом, клетки производят белок лишь на короткое время, что с меньшей вероятностью вызовет иммунный ответ или внесет изменения в эпигеном в непредусмотренных местах. Такие наночастицы считаются безопасными, особенно после того, как за последние 2 года они были введены сотням миллионов людей для доставки мРНК для вакцин COVID-19.
Итальянской команде потребовалось еще несколько лет, чтобы воплотить свои лабораторные исследования в успешные результаты на животных. На встрече по геномике Мартино Каппеллути подробно рассказал о том, как его сотрудники вводили мышам жировые частички, несущие мРНК, кодирующие эпигеномные редакторы, предназначенные для глушения живого гена PCSK9, который влияет на уровень холестерина. Стратегия сработала: одна инъекция подавила уровень белка PCSK9 в крови на 50% и снизила уровень липопротеина низкой плотности, или "плохого" холестерина, по крайней мере, на 180 дней.
"Я считаю это серьезным достижением", - говорит Урнов, который надеется, что подход с использованием липидных наночастиц вскоре будет распространен и на другие генетические заболевания. "Главное здесь то, что необязательно, чтобы редактор эпигенома продолжал экспрессию", - говорит Джонатан Вайсман из Института Уайтхед. В прошлом году Вайсман был одним из руководителей работы, о которой сообщалось в журнале Cell, по усовершенствованию редакторов эпигенома на основе CRISPR, которые вносят длительные изменения.
Исследователи говорят, что редактирование эпигенома может быть особенно полезным для управления более чем одним геном, что труднее сделать безопасным при редактировании ДНК. Это может помочь в лечении таких заболеваний, как синдром Драве, при котором человек производит некоторое количество необходимого белка, но не достаточно, потому что, подобно светорегулятору, эта стратегия может плавно регулировать экспрессию генов, не включая и не выключая их полностью. Несколько новых компаний надеются коммерциализировать методы лечения с использованием редакторов эпигенома.
Несмотря на воодушевление, исследователи предупреждают, что потребуется время, чтобы редактирование эпигенома приобрело широкое влияние. По словам исследователя эпигенетики Дэвида Сигала из Калифорнийского университета, редакторы не всегда работают так, как заявлено, в отношении некоторых генов. Отчасти это может быть связано с тем, что, как отмечает исследователь эпигенетики Джон Стаматояннопулос из Университета Вашингтона, исследователи не понимают, что именно делают редакторы, когда они проникают в клетки. Это "черный ящик", - говорит он.
Тем не менее, Стаматояннопулос согласен с тем, что редактирование эпигенома имеет "огромные перспективы". Теперь исследователям необходимо доработать свои редакторы эпигенома, опробовать их на других генах заболеваний и тканях и протестировать их на крупных животных на предмет безопасности, прежде чем переходить к людям.