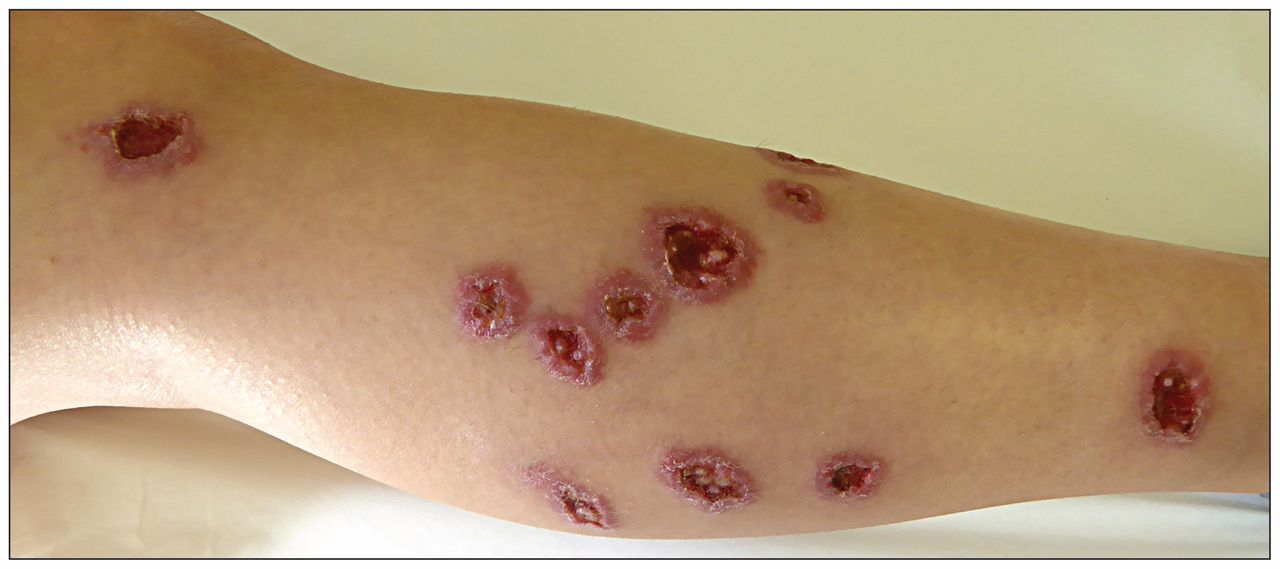
В недавнем исследовании, размещенном на сервере препринтов medRxiv, ученые из Бразилии и США изучили вероятное влияние микробиоты кожи на исходы кожного лейшманиоза.
Кожный лейшманиоз, вызываемый Leishmania braziliensis, приводит к воспалению и повреждению кожи с непредсказуемым и весьма вариабельным исходом. Инфекция может проявляться клинически в виде одиночных заживающих дерматологических поражений или хронических кожных язв, с поражениями слизистых оболочек и диссеминированными поражениями. Количество паразитов и иммунологические реакции хозяина могут повлиять на прогноз заболевания. Лечение пятивалентной сурьмой (Sbv) не помогает устранить поражения, а терапевтические вакцины отсутствуют. Поэтому улучшение понимания иммунопатогенеза заболевания может помочь в разработке целевых и эффективных препаратов против Leishmania braziliensis.
В исследованиях сообщалось, что нарушение целостности кожи Leishmania braziliensis приводит к дисбиозу микробиома, способствуя патологическим изменениям и повышению уровня воспалительных цитокинов и хемокинов, таких как интерлейкин-17 и интерлейкин-1β. Однако клиническая значимость иммунологических данных неясна. В данном исследовании ученые выясняли, влияет ли микробиом кожи на иммунологические реакции и исходы кожного лейшманиоза.
Группа провела комплексный мультитранскриптомный анализ микробиома кожи и транскриптома 62 человек, инфицированных L. braziliensis, среди которых было 20 и 42 мужчины и женщины соответственно, средний возраст участников составил 30 лет. Мазки пораженной и контралатеральной непораженной кожи были подвергнуты ампликонному секвенированию 16S рРНК (16S-seq) для оценки микробных профилей.
Биоптаты пораженных тканей были подвергнуты анализу секвенирования РНК для определения транскриптомных профилей хозяина, а для количественной оценки бактериального бремени поражения была проведена количественная ПЦР. В связи с большим количеством Staphylococcus aureus в очагах поражения, что было определено дифференциальным анализом обилия таксонов между образцами мазков с пораженной и контралатеральной непораженной кожи, был создан специализированный пан-геном Staphylococcus aureus с использованием клинических изолятов S. aureus. Для изучения вероятного вклада индуцированного бактериями Staphylococcus aureus интерлейкина-1β в патогенез заболевания, у мышей, инфицированных L. braziliensis и колонизированных S. aureus были нейтрализованы сигнальные пути IL-1β. Кроме того, были проведены анализ непрерывной дифференциальной экспрессии генов (DGE) и анализ онтологии генов (GO).
В полученные данные вошли:
(i) данные анализа секвенирования РНК из биоптатов пораженных участков (n=51), полученные до терапии Sbv;
(ii) набор данных секвенирования 16S рибосомальной рибонуклеиновой кислоты из образцов мазков, полученных с пораженных поверхностей до терапии Sbv и во время наблюдения (с 30-го по 240-й день) у нескольких пациентов;
(iii) библиотека S. aureus, приготовленная из образцов поражения, и их генетические последовательности; и
(iv) данные клинического мета-анализа, включая демографические переменные. Данные клинического мета-анализа включали место и размер поражения, лимфаденопатию, показатели гиперчувствительности замедленного типа, продолжительность заживления и исходы заболевания.
Бактериальное бремя было более значительным в пораженных мазках, чем в мазках с непораженной, контралатеральной кожи, и у 84% пациентов наблюдались изменения микробиома кожи при лейшманиозных поражениях. В микробиоме поражения преобладали Staphylococcus aureus, затем Streptococcus и Corynebacterium. Обилие золотистого стафилококка ассоциировалось с задержкой заживления, худшими клиническими исходами и повышенной экспрессией воспалительных цитокинов семейства IL-1, особенно IL-1β, и хемокинов семейства C-X-C motif ligand (CXCL), участвующих в хемотаксисе нейтрофилов.
IL-1β играет важную роль в модуляции исходов кожного лейшманиоза у мышей, колонизированных S. aureus, а нейтрализация IL-1β уменьшает воспаление. Результаты показали, что IL-1 определяет тяжесть заболевания в лейшманиозных поражениях у мышей с преобладанием S.aureus, и поэтому IL-1 может быть направлен на разработку терапевтических средств для лечения кожного лейшманиоза у людей. У пациентов с повышенным количеством S.aureus наблюдалась отсроченная реакция на лечение, а поражения сохранялись более 300 дней.
Результаты показали, что повышенное количество паразитов связано с неудачами в лечении и что долгосрочные изменения, наблюдаемые в микробиоме лейшманиозного поражения, не могут быть обусловлены только лечением Sbv. Отклонения в микробиоме поражения были связаны с повышенной экспрессией провоспалительных генов. Результаты исследования показали связь между микробиомом поражения, клиническими исходами, цитотоксическими и провоспалительными транскриптомами хозяина, но не с ответами, связанными с В-лимфоцитами.
В очагах поражения с повышенным количеством L. braziliensis наблюдались провоспалительные генетические сигнатуры, а также повышенное количество цитотоксических Т-лимфоцитов и натуральных киллеров. Колонизация S. aureus способствовала развитию заболевания у мышей из-за усиления воспаления, что указывает на то, что S. aureus способствовал развитию воспаления, связанного с лейшманиозом, и исходам заболевания.
Гены, наиболее сильно ассоциированные с лейшманиозом, включали гены, кодирующие связанные с цитотоксичностью рецепторы и эффекторные вещества, такие как перфорин-1, гранулизин, гранзим B и иммуноглобулиноподобный рецептор клеток-киллеров 2DL4 (KIR2DL4). Другие связанные гены кодируют хемотаксис нейтрофилов и эффекторные функции, такие как CXCL-3, молекула клеточной адгезии 3 (CEACAM3), связанная с карциноэмбриональным антигеном, и CXCL-1; и воспалительные цитокины, такие как IL-1α, -1β,-24, ингибитор секреторной лейкоцитарной пептидазы (SLPI) и онкостатин М.
В целом, результаты исследования показали, что микробиом кожи при лейшманиозных поражениях влияет на прогрессирование заболевания и может задерживать время заживления из-за повышенного уровня IL-1.