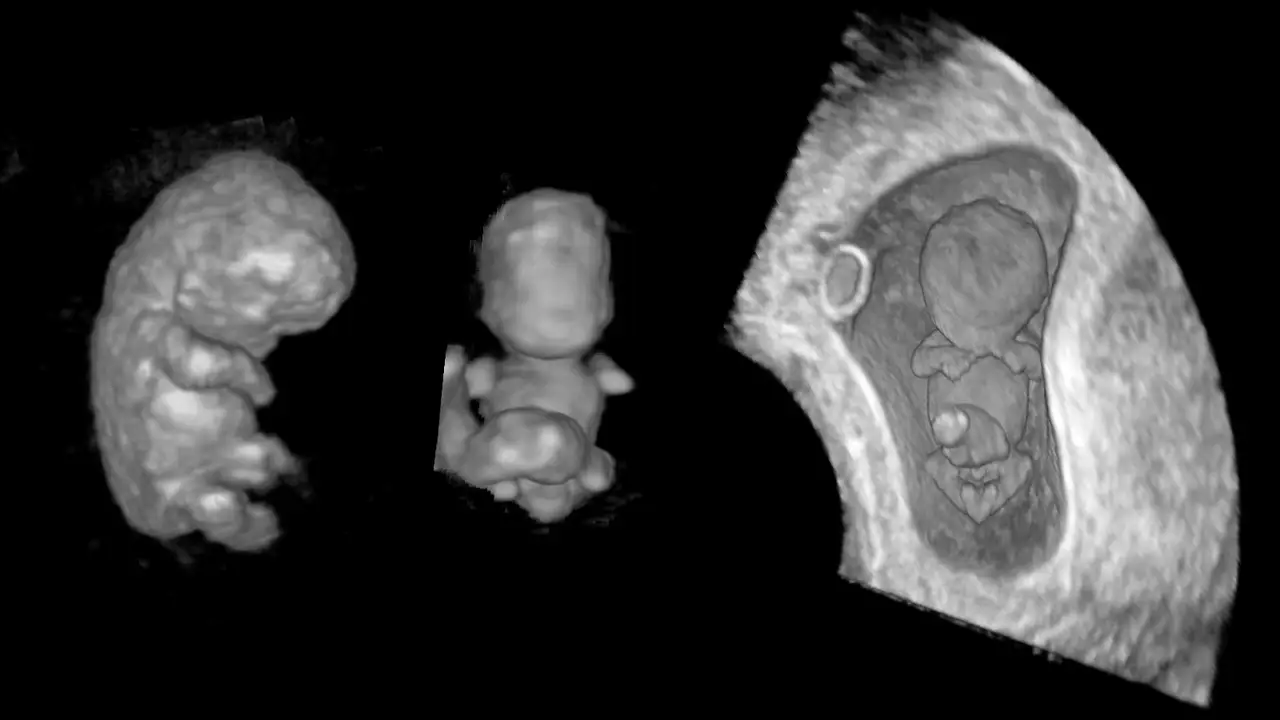
Жизнь как движение
Споры о том, когда начинается человеческая жизнь, уходят корнями глубоко в историю философии. Однако до недавнего времени они были ограничены уровнем развития технологий. Ни один ученый не мог стать свидетелем зарождения новой человеческой жизни, скрытой в матке, поскольку не существовало методов, позволяющих заглянуть внутрь и непосредственно наблюдать за ней.
Ученые-естествоиспытатели предпринимали несколько попыток провести границу между одушевленным эмбрионом и неодушевленной субстанцией. Аристотель, например, считал, что мужской эмбрион обретает душу на 40-й день развития, однако единственным доказательством благополучной беременности, которое оставалось общепринятым вплоть до XIX века, было первое движение плода. Так, в Англии XVIII века только шевеление плода могло служить основанием для помилования беременной женщины, приговоренной к повешению.
Здоровье эмбриона на ранних стадиях не вызывало особого беспокойства ни у матерей, ни у ученых. Некоторые исследователи с легкостью пожертвовали бы эмбрионом или плодом, чтобы превратить его в препарат целого тела или набор гистологических срезов. Ярким примером такого отношения стала история коллекции эмбрионов Института Карнеги. В первой половине двадцатого века Институту Карнеги удалось собрать несколько тысяч человеческих эмбрионов. Охотясь за эмбрионами, исследователи внимательно наблюдали за женщинами, которым была назначена гистерэктомия. Из любой удаленной матки они могли получить новый образец - иногда случайно (поскольку точных тестов на беременность еще не было), а иногда целенаправленно, если женщину просили забеременеть незадолго до операции. Этот метод почти не вызвал дискуссий в обществе и на его основе исследователи Карнеги разработали таблицу стадий развития человека, которая широко используется и по сей день.
Однако быстрое развитие не самый лучший критерий жизни. Время первого шевеления варьируется в широких пределах и в основном зависит от матери, а не от плода. Некоторым женщинам (в основном первородящим) приходится ждать почти до третьего триместра беременности, чтобы заметить первые движения ребенка, в то время как другие чувствуют их уже к концу первого. Нужен был более точный критерий, но никто не призывал искать его - возможно, потому, что врачи того времени не могли изменить процесс развития человека и единственная манипуляция, которую они могли провести с зарождающейся жизнью, заключалась в ее изъятии.
Однако к концу XIX века эти манипуляции были повсеместно запрещены, поскольку католическая церковь заявила, что эмбрион должен считаться живым на любой стадии развития, независимо от того, «одушевлен» он или нет. Тем не менее, существует несколько механистических препятствий, которые затрудняют использование этого критерия, особенно в клинических условиях.
Жизнь как слияние
Модель, в которой каждый эмбрион считается живым подразумевает, что возникновение жизни равносильно появлению новой клетки, не идентичной ни материнской, ни отцовской. Наиболее очевидное свойство, приобретаемое этой новой клеткой, это, по-видимому, уникальный набор генов. Однако зигота не имеет ни собственного ядра, ни готового набора генов. Единственные РНК, которые «работают» в клетке, поддерживая синтез белка после оплодотворения, - это те, что унаследованы от яйцеклетки. Материнские и отцовские хромосомы остаются плотно упакованными и выстраиваются в центре клетки, образуя митотическое веретено для первого деления. Во время расщепления хромосомы перемешиваются между дочерними клетками и только к первой телофазе происходит сборка новых хромосомных наборов.
Можно также предположить, что сборка ядра не является функциональной границей и что нулевая точка жизни должна быть установлена, когда вновь образованный геном начинает экспрессировать свои собственные гены. Тогда она должна быть установлена еще позже, поскольку первые бластомеры полагаются на материнскую РНК со 2-4-го дней, когда геном зиготы полностью активируется, хотя недавние исследования показывают, что эмбриональная экспрессия генов может начаться уже на одноклеточной стадии. Однако если маркером служит активность генов, то время наступления нулевой точки может быть различным в зависимости от того, какие именно гены считаются ключевыми для развития эмбриона. Например, первое событие дифференцировки зависит от экспрессии гена Cdx2, которая специфична для будущей трофэктодермы и происходит позже, примерно на 5-й день после оплодотворения.
Эта генетическая двусмысленность не была проблемой в XIX веке, но, несомненно, станет таковой сейчас, например, в условиях ЭКО. Должна ли каждая «свежеоплодотворенная» зигота считаться человеком или эмбриологам следует дождаться экспрессии генов? Это не единственное препятствие для того, чтобы считать жизнь начавшейся в момент оплодотворения. До определенного момента развития (который наступает примерно в две недели) эмбрион млекопитающего может разделиться на несколько отдельных существ. Этот процесс происходит естественным образом, то есть так образуются монозиготные близнецы. Если жизнь начинается в момент оплодотворения, то можно ли разделить ее на две жизни?
Ранние эмбрионы также могут быть объединены в один химерный организм. Этот процесс лежит в основе феномена «исчезающего близнеца», когда один эмбрион-близнец сливается с другим. Затем клетки исчезнувшего близнеца рассеиваются в тканях сохранившегося близнеца и впоследствии могут проявиться в виде одновременного присутствия разных групп крови, клеток, несущих Y-хромосому в женском организме, или зародышевой линии в организме другого близнеца. Более того, химеры могут быть созданы из ранних эмбрионов, принадлежащих к разным видам. Это можно проиллюстрировать сообщениями о различных химерах млекопитающих, не относящихся к приматам, таких как химеры крысы и мыши, которые развиваются в жизнеспособных животных. Эмбриональные стволовые клетки человека также сохраняют способность выживать в эмбрионах неприматов (например, свиньи или мыши).
Можно утверждать, что эти наблюдения доказывают, что на ранних стадиях развития эмбрион не может различать «я» и «не я». Хотя химеры между близкородственными видами образуются легче, чем между дальними (первая химера между человеком и обезьяной состояла на 7% из человеческих клеток, что гораздо больше, чем большинство химер между человеком и мышью), а уровень апоптоза в этих смешанных эмбрионах остается высоким, тот факт, что из них может получиться жизнеспособный плод, говорит о том, что отторжение чужеродных клеток не слишком велико. Это неудивительно, поскольку ранние эмбрионы не обладают надлежащей иммунной системой, а главный комплекс гистосовместимости, предположительно, начинает действовать только на более поздних стадиях. Тем не менее, такая готовность принять клетки другого существа и даже другого вида кажется противоречащей идее о том, что жизнь начинается в самом начале развития.
Жизнь как самодостаточность
Светские власти постепенно смягчали правила. Они признали, что аборт может быть оправдан социальными или медицинскими проблемами до того, как плод приобретет определенную физиологическую самостоятельность. Однако определить точку, с которой начинается самодостаточная жизнь и за которой ее прекращение недопустимо, было непросто.
Критерии смерти как конечной точки жизни хорошо известны, хотя и постоянно меняются. Мы привыкли определять ее как прекращение дыхания и сердцебиения или исчезновение электрической активности мозга. Но те же правила не работают в обратную сторону, поскольку жизненно важные органы появляются не одновременно и развиваются постепенно. Например, первые движения диафрагмы плода (которые, однако, еще не являются настоящим дыханием) можно обнаружить уже на 10-й неделе развития, а первые сокращения того, что однажды станет сердцем, появляются уже на третьей неделе (хотя ни слои сердца, ни камеры еще не сформированы).
В некоторых законодательствах медицинские показания (когда существует значительный риск для матери) оправдывают аборт вплоть до самого рождения ребенка. А в большинстве западных стран сегодня женщинам разрешено просить об аборте независимо от риска для здоровья до определенного момента, который официально установлен как момент, когда плод становится жизнеспособным, то есть может существовать вне матки (пусть и с помощью врачей). Однако эта временная точка постоянно смещается. В 1970-х годах это было начало третьего триместра (27 недель), затем стало возможным поддерживать жизнь ребенка уже на 22-й неделе после зачатия. Есть сообщения о том, что недоношенные дети выживали даже на 20-й неделе. Можно ожидать, что по мере дальнейшего развития неонатологии этот порог также будет смещаться, и тогда нулевая точка человеческой жизни, определенная таким образом, может зависеть от страны, клиники или даже навыков конкретного врача. Очевидно, что после создания системы, имитирующей искусственную матку, все эти правила потребуют очередного пересмотра.
Таким образом, долгое время закон защищал только те эмбрионы, которые могли выжить независимо от матери, и был ориентирован только на прекращение сформировавшейся жизни, имплантированной в матку. Все остальные стадии развития человека оставались недоступными для врачей. Так было до 1978 года, когда родилась Луиза Браун.
Родители Луизы, Лесли и Джон Браун, не были ни серьезно больны, ни генетически несовместимы. Однако в течение девяти лет они не могли зачать ребенка естественным путем, поскольку фаллопиевы трубы Лесли были сильно деформированы. Многочисленные операции не помогли устранить закупорку, поэтому лечащий врач предложил новый вариант. Он назвал это «реимплантацией» эмбриона в матку - сейчас мы называем это «экстракорпоральным оплодотворением», или ЭКО: здесь сперматозоид и яйцеклетка встречаются в чашке Петри, эмбрион выращивают и наблюдают в течение нескольких дней, а затем переносят в матку женщины.
Луиза Браун родилась в срок, и ее роды ничем не отличались от родов любой другой британской девочки, если не считать полицейской охраны у больницы. Правительство опасалось, что этот случай может привлечь слишком много внимания СМИ, что и произошло. После рождения первого так называемого «ребенка из пробирки» (хотя на самом деле никакой пробирки в этом процессе не было) стало ясно, что их будет гораздо больше, поскольку спрос был чрезвычайно высок. В то время считалось, что примерно каждая десятая семья в Великобритании была бездетной.
Вторая дочь супругов Браун, Натали, родившаяся четыре года спустя, считается сороковым ребенком в мире, рожденным с помощью ЭКО. По мере того как все больше бесплодных пар узнавали о том, что у них есть шанс родить ребенка, дети «in vitro» появлялись в США, Австралии и Индии. В 2018 году врачи оценили количество детей, рожденных после ЭКО, в восемь миллионов.
Прорывные технологии часто не приходят в одиночку. Процедура ЭКО состоит из множества этапов, среди которых само оплодотворение - не самый сложный. Чтобы перенести многодневный эмбрион в матку Лесли Браун, врачам пришлось научиться извлекать яйцеклетки и сперматозоиды родителей, поддерживать их жизнеспособность, заставлять их находить друг друга in vitro, а затем - что, возможно, является самым важным шагом - культивировать эмбрион и проверять, нормально ли он развивается.
С рождением Луизы Браун началась новая эра, когда врач мог влиять не только на жизнь уже родившегося человека, но даже на развитие еще не зачатого. Эмбриологам еще только предстояло научиться замораживать и размораживать эмбрионы, удалять отдельные бластомеры или заменять определенные гены на новые. Но они уже предвидели, что рано или поздно это произойдет, и понимали, что открываются возможности для еще более сложных манипуляций с человеческими эмбрионами. Фантазия ученых разгулялась. В начале 1980-х годов они уже могли представить себе тестирование лекарств на эмбрионах, выращивание детей вне матки (эктогенез) или в теле других животных, партеногенез (создание эмбриона из яйцеклетки без участия сперматозоидов), клонирование человека и - конечно же! - генетическое улучшение людей.
Невозможно представить, как может выглядеть жизнь ребенка, родившегося после подобных манипуляций, и какие долгосрочные последствия это может иметь для его благополучия. Как предсказать, что может произойти в голове человека, наделенного только материнскими генами? Или же как вам ребенок, выращенный в свиной матке? Однако бездетность считалась важной проблемой. В обществе уже существовал значительный спрос на репродуктивные технологии. И очевидно, что развитие репродуктивных технологий подразумевает доработку и тестирование базовых процедур, что невозможно без экспериментов на ранних человеческих эмбрионах. Таким образом, требовался компромисс между желанием дать шанс на существование тем, кто был его лишен, и риском разрушить это существование.
Появление новых технологий влекло за собой новую ответственность. Научное сообщество должно было серьезно задуматься о том, как распорядиться открывающимися новыми возможностями. Поэтому в Великобритании в 1982 году был собран Комитет по изучению человеческого оплодотворения и эмбриологии. Он также известен как Комитет Уорнок, по имени его председателя, писательницы и философа Мэри Уорнок. Перед комитетом была поставлена задача провести грань между приемлемыми и неприемлемыми экспериментами с эмбрионами. В течение двух лет члены комитета опросили около 300 врачей и эмбриологов и изучили мнения почти 700 сограждан. Их вердикт был вынесен в 1984 году - когда обе «пробирочные» сестры Браун уже крепко стояли на ногах.
К 1984 году никакие эксперименты не могли проводиться без информированного согласия человека, над которым проводились эксперименты. Однако эмбрион не может быть информирован и не имеет возможности дать согласие. Должно ли это послужить основанием для запрета всех экспериментов с эмбрионами, лишая тысячи бесплодных пар шанса на репродукцию и оставляя многие патологии развития неизученными и неизлечимыми? Или, наоборот, следует ли считать эмбрион не живым человеком, поскольку он не имеет сознания и не обладает большинством человеческих свойств?
Впервые требовался строгий ответ на вопрос о том, когда начинается жизнь человека. Однако это был единственный вопрос, на который комитет Уорнок не ответил. С самого начала было ясно, что ни один ответ не устроит всех в равной степени. Именно поэтому комитет вынес вердикт, в котором говорится, что вопрос о начале человеческой жизни не имеет единственного ответа. Хотя он кажется вопросом «факта, на который можно дать прямой ответ», - заявил Комитет, - мы считаем, что ответы на такие вопросы на самом деле представляют собой сложную смесь фактических и моральных суждений", - утверждал Комитет. Такая формулировка не поможет направить исследование». Вместо этого Комитет поставил другой вопрос, инструментальный: на какой стадии развития оправдано уничтожение человеческого эмбриона, если с ним что-то не так?
У Комитета был предшественник - Консультативный совет по этике при Министерстве здравоохранения, образования и социального обеспечения США, который пытался решить аналогичную проблему несколькими годами ранее. В своем знаковом отчете 1979 года под названием «Поддержка исследований, связанных с экстракорпоральным оплодотворением человека и переносом эмбрионов» Совет предложил не выращивать эмбрионы в культуре дольше 14 дней. Этот выбор, как утверждалось, был обусловлен сроками имплантации. На самом деле члены совета высказали полярные мнения по этому вопросу, и 14-й день был выбран как произвольная точка, когда эмбрион уже должен был имплантироваться в матку, но не мог развить никаких дифференцированных тканей.
В отличие от отчета 1979 года, который так и не был применен в клинической практике, решение Комитета Уорнок оказалось очень весомым. Комитет выбрал ту же временную точку для проведения границы, но привел дополнительные аргументы в пользу этого. Он решил подходить к вопросу экспериментов с эмбрионами так же, как и с любыми другими людьми. Этика клинических испытаний предполагает, что польза должна перевешивать страдания. Но поскольку мы не можем измерить интенсивность страданий эмбриона, единственный период, когда мы можем быть уверены, что польза выше, - это когда страданий нет вообще.
Однако было неизвестно, когда именно эмбрион обретает способность страдать. Поэтому Комитет основывал свое решение на моменте, когда у эмбриона появляются первые признаки нервной системы, а это 17-й день развития. Тем не менее, комитет признал, что это не самая точная оценка, и по мере углубления наших знаний о развитии человека эта граница может быть сдвинута еще дальше. Поэтому, не желая идти на такой риск, Комитет решил установить границу на несколько дней раньше. В результате получилось 14 дней. Позже Мэри Уорнок призналась, что граница в 14 дней была не единственным вариантом. С таким же успехом можно было выбрать 13 или 15 дней, и ничего бы не изменилось. Она выбрала 14 - «просто потому, что все умеют считать до 14; две недели - хорошее, запоминающееся число, и можно вести учет неделя за неделей».
Теперь, когда мы знаем гораздо больше о развитии человеческого мозга, становится очевидным, насколько произвольным было это ограничение. В недавнем докладе говорится, что в 16-19-дневных человеческих эмбрионах не удается обнаружить нейронных предшественников. Также хорошо известно, что синхронизированные импульсы нейронов в периферической нервной системе можно обнаружить не ранее второго месяца развития. И все же это не означает, что эмбрион уже способен чувствовать боль. Исследования показывают, что нервная система эмбриона полностью «созревает для страданий» только к 19-й неделе после оплодотворения. То, что можно принять за нервную систему у 14-дневного эмбриона, - это лишь обозначение, размытая тень того, что однажды станет полноценным головным и спинным мозгом. Поэтому, если бы кто-то использовал этот критерий для определения границ человеческой жизни, он также столкнулся бы с многочисленными несоответствиями.
Однако в докладе Комитета достаточно ясно сказано, что ни один критерий не может быть универсальным и всеобъемлющим. Это был компромисс, на который следовало пойти, чтобы все чувствовали себя услышанными - и те, кто отстаивает религиозные принципы, и те, кто разрабатывает новые репродуктивные технологии, и те, кто ждет своего шанса родить ребенка. Тем не менее, стадия 14-го дня по-прежнему привлекает внимание биологов, поскольку она сопровождается более очевидными переходами, которые знаменуют собой фундаментальный этап развития.
Жизнь как уникальность
Первые две недели развития человека представляют собой однослойный клеточный диск, окруженный несколькими пузырьками зародышевых мембран. К третьей неделе начинается процесс, который делает этот диск более человекоподобным (см.рис.). Этот процесс называется гаструляцией - «поистине самое важное время в вашей жизни», согласно цитате, приписываемой эмбриологу Льюису Вольперту.
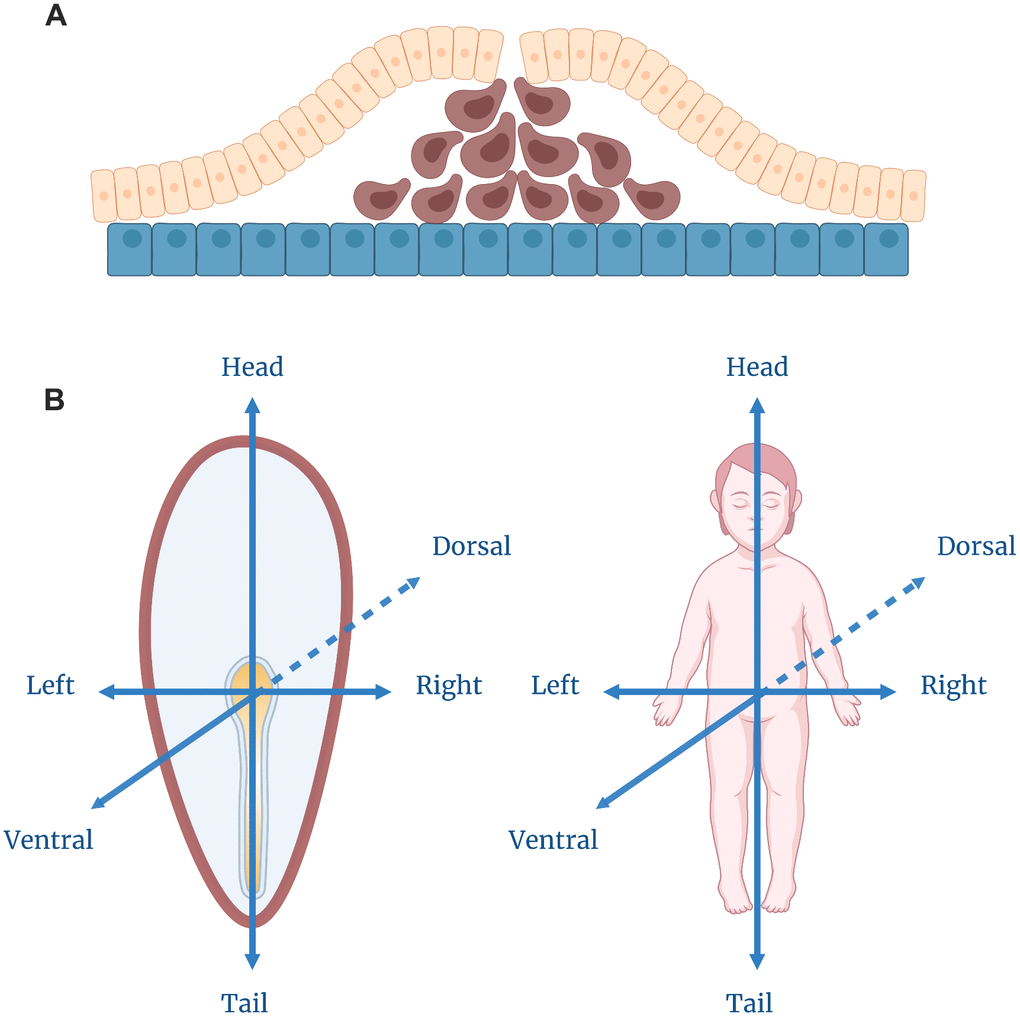
Гаструляция. (A) Движение клеток в процессе гаструляции. Желтый слой изображает эпибласт, а синий - гипобласт. Клетки коричневого цвета мигрируют, образуя сначала слои эндодермы, а затем мезодермы. (B) Спецификация осей в гаструлирующем эмбрионе, соответствующая окончательному плану тела человека.
Есть одно важное свойство, которое отличает архетипического человека от клеточного диска: человек состоит из трех слоев. Можно представить себе все человеческое тело как трехслойный сэндвич, обернутый вокруг полой трубки (кишечника). Гаструляция не обеспечивает эмбрион нормальным кишечником, но в результате образуется трехслойный диск, гомологичный стадии гаструлы в развитии позвоночных.
Получившаяся структура не похожа на человеческое тело в том виде, в котором мы привыкли его видеть. Однако опытный биолог может с уверенностью сказать, как он будет выглядеть, когда вырастет. Там, где появилось первое утолщение, впоследствии разовьется задний конец тела, противоположная сторона диска сформирует передние структуры головы. Мигрирующие клетки направляются к вентральной стороне тела, а оставшиеся наружные клетки превращаются в дорсальную сторону. В центре этой дорсальной области клетки станут нервной системой: они продолжат делиться и погрузятся под верхний слой, где сформируют головной и спинной мозг. Через неделю мы получим прототип типичного позвоночного животного, у которого голова противоположна хвосту, а нервная трубка, нотохорда и кишечник выстроены вдоль дорсально-вентральной оси - структурный план, одинаковый для человека, ящерицы, лягушки и рыбы.
Однако чем более детализированным становится эмбрион, тем сложнее разделить его на несколько частей. На предыдущих стадиях развития, когда эмбрион представлял собой лишь сгусток однородных клеток, его можно было легко разделить на два (или более) отдельных сгустка, которые продолжали бы развиваться независимо друг от друга и могли бы вырасти в однояйцевых близнецов - каждый с полным набором собственных органов. Затем каждое морфогенетическое событие делает такое деление более рискованным. После установления передне-задней оси уже невозможно разделить трехслойный диск на равные части, чтобы каждая из них имела полный набор органов (по крайней мере, таких сообщений не было). Единственный вариант для тех эмбрионов, которые «опоздали» с появлением брата или сестры и разделились после 14-го дня, - это иметь одно тело и стать сиамскими близнецами. Санкции за опоздание суровы: часто один или оба близнеца оказываются нежизнеспособными.
Таким образом, 14-й день развития оказывается парадоксально значимым событием. В этот момент, с одной стороны, будущий человек приобретает форму и черты, общие для всех позвоночных.
С другой стороны, именно с этого момента начинается его индивидуальное развитие - второго такого же с теми же генами уже не будет.
В поисках безопасного момента, когда эмбрион не способен чувствовать боль, комитет Уорнок остановился на дате, когда будущий человек действительно обретает свою уникальность. Возможно, это одна из главных причин, почему «правило 14 дней» было широко принято и строго соблюдалось в течение последующих 37 лет.
Расширяя границы
В отчете Комитета Уорнок говорится, что «ни один живой человеческий эмбрион, полученный в результате экстракорпорального оплодотворения, как замороженный, так и размороженный, не может быть сохранен живым, если он не пересажен женщине, после четырнадцати дней после оплодотворения, и не может быть использован в качестве объекта исследования после четырнадцати дней после оплодотворения». К 15-му дню эмбрионы должны быть уничтожены. И эта рекомендация (так называемое «правило 14 дней») вскоре была принята - не только британским правительством, но и другими странами. Где-то, как в Японии или Бельгии, оно было включено в закон, в некоторых других странах (например, в США) исследования человеческих эмбрионов полностью лишены федерального финансирования. Позже это правило вошло в рекомендации Международного общества по исследованию стволовых клеток: в обновленной версии оно запрещало культивировать человеческие эмбрионы дальше стадии примитивной полоски, независимо от того, сколько дней они фактически провели в лабораторных условиях.
В 1984 году это правило устраивало не всех. Комиссию Уорнок обвинили в том, что она была слишком утилитарной и касалась технических аспектов создания детей, игнорируя при этом моральные. Тем не менее эмбриологи, казалось, вполне вписывались в новые правила: двухнедельное препятствие было более чем достаточно для их текущих исследовательских целей. В то время никто из них не смог бы переступить эту черту - эмбрионы все еще не могли самостоятельно выживать так долго.
Однако главная проблема заключалась не только в питании и кислороде - их можно было легко обеспечить in vitro. Эмбрион млекопитающих очень сильно зависит от материнского организма как источника пространственных сигналов, которые координируют топологию его развития. Клетки эндометрия обеспечивают эмбриону механическую поддержку, а также вырабатывают сигнальные факторы, влияющие на специализацию экстраэмбриональных тканей, которые, в свою очередь, участвуют в процессе гаструляции. Поэтому в тот момент, когда Мэри Уорнок предложила свое «памятное число», это не означало нанесения ущерба каким-либо текущим исследованиям. Таким образом, это не было фактическим компромиссом, это было ограничение, которое никто не мог преодолеть, хотя и предполагалось, что это возможно в будущем. Время для настоящего компромисса еще не пришло.
С тех пор технологии изменились до неузнаваемости. Эмбриологи получили доступ к синтетическим полимерным подложкам, трехмерным скаффолдам, 3D-принтерам, микрофлюидным устройствам и самым современным системам обслуживания инкубаторов. Сейчас доступно гораздо больше возможностей, что делает условия в культуре гораздо более похожими на материнскую утробу. Следовательно, чем больше поддержки эмбрион получает от искусственной «матери», тем дальше он может развиваться.
Первый вызов правилу 14 дней был брошен в 2014 году, когда группа ученых использовала морфоген, чтобы заставить кластер человеческих плюрипотентных стволовых клеток сформировать несколько типов эмбриональных клеток. Полученная структура не была похожа на эмбрион морфологически, однако повторяла трехслойный паттерн организации, поэтому такую структуру назвали гаструлоидной. Позже, в 2016 году, стало возможным культивировать настоящий человеческий эмбрион в течение более длительного времени, имитируя постимплантационные стадии, а в 2018 году из стволовых клеток был собран синтетический эмбрион (бластоид).
Конечно, ни одно из этих эмбрионоподобных существ не было способно к самостоятельному развитию. Хотя гаструлоиды демонстрировали четкое различие (подтвержденное экспрессией генов) между внешним, внутренним и средним слоями, они не имели внеэмбриональных тканей и не повторяли структурный план раннего человеческого эмбриона. Только в 2019 году микрофлюидные технологии предоставили возможность вызывать формирование передних и задних структур внутри эмбриона. Однако полностью передне-задний паттернинг все еще был недостижим. Хотя эмбрионоподобные структуры демонстрировали четкую дорсо-вентральную полярность, каждая из них развивала либо передние, либо задние черты.
В 2021 году стало возможным имитировать все раннее развитие человека in vitro. Трем независимым группам удалось создать бластоиды - структуры, напоминающие бластоцисты, - из однородной культуры плюрипотентных стволовых клеток. Генерация бластоидов обеспечила искусственные эмбрионы экстраэмбриональными клетками, которые могут быть полезны для воссоздания имплантационных и постимплантационных стадий развития in vitro. Еще одно прорывное достижение 2021 года приблизило нас к искусственной матке. Группа ученых усовершенствовала давно известную технологию внеутробного культивирования цельных эмбрионов и добилась успеха в выращивании эмбрионов мыши в биореакторе вплоть до 11-го дня развития. На этом этапе у эмбрионов появляются бьющиеся сердца, функциональная кровеносная система и частично развитые конечности.
Ключом к успеху стала разработка уникальной системы вентиляции и поддержания атмосферного давления, которая обеспечивает выравнивание уровня кислорода, использует сыворотку, полученную из плаценты, и защищает эмбрионы от деформации. Для дальнейшего продления периода эмбриогенеза in vitro важно разработать систему кровоснабжения или искусственную плаценту. По аналогии с эмбрионами мышей, человеческие эмбрионы можно будет выращивать гораздо дольше 14-дневного порога. То, что в 1980-х годах звучало как пугающие фантазии, в 2021 году стало научной реальностью. Таким образом, пришло время для настоящего компромисса между этическими вопросами, касающимися экспериментов с человеческими эмбрионами, и учеными, углубляющимися в развитие человека и репродуктивные технологии.
После 14 дней
До сих пор исследователи добросовестно уничтожали результаты всех этих экспериментов - по крайней мере, в каждом экспериментальном отчете на эту тему подчеркивалась временная точка, после которой все процедуры культивирования прекращались. Однако сам факт того, что долгосрочное культивирование эмбрионов стало возможным, вызвал новый виток дискуссии в научном сообществе. Начиная с 2016 года, каждый год появляется как минимум одна статья с предложением сдвинуть границу, за которой эксперименты считаются допустимыми. Поначалу ученые просто напоминали, что правило 14 дней не должно действовать как моральная догма. Они также признавали, что с 1984 года мы многое узнали о развитии нервной системы человека и теперь можно быть уверенным, что после 14-го дня эмбрион еще долго будет оставаться «нечувствительным» к экспериментам. Совсем недавно начали обсуждать практическую необходимость таких экспериментов.
Родившиеся в конце 2018 года первые генетически модифицированные дети, как и сестры Браун, положили начало очередной революции в медицине. Научное сообщество осудило Цзянькуй Хэ, который провел эту процедуру, однако стало очевидно, что спектр репродуктивных технологий значительно расширился. Современные методики позволяют не только зачать ребенка in vitro, но и манипулировать его генами - до того, как они начнут формировать нового человека. Чтобы выяснить, влияют ли вновь введенные генетические изменения на развитие человека, нам потребуется более длительное наблюдение за эмбрионом. Двух недель может быть недостаточно, учитывая, что на этой стадии у эмбриона нет даже соответствующих тканей, не говоря уже об органах или частях тела.
Каждая последующая публикация приводила все больше аргументов и предложений о новых возможных границах. Одни предлагали считать моментом начала развития нервной системы момент, который каким-то образом совпадает с первыми сокращениями сердца (тоже символический признак жизни), то есть через 22 дня после оплодотворения. Другие призывают расширить границу, до момента появления первых чувствительных предшественников нейронов, которые впоследствии смогут передавать болевой сигнал. Этот момент соответствует 29-31 дню развития. Некоторые ученые придерживаются отметки в 28 дней, утверждая, что более поздние стадии развития могут быть в достаточной степени изучены на абортивном материале. Однако до 28-го дня аборты обычно не делаются, поэтому наши знания о том, что происходит между 14 и 28 днями, весьма ограничены.
Наконец, есть сторонники индивидуальных подходов - те, кто предлагает принимать конкретные решения после рассмотрения прямых плюсов и минусов долгосрочного культивирования эмбрионов в рамках каждого конкретного эксперимента. Это похоже на то, что происходит сейчас с редактированием генома - в этой области эксперты также склонны принимать индивидуальные решения в зависимости от того, насколько безопасным и оправданным они считают тот или иной метод «исправления генов».
Мэри Уорнок дожила до того времени, когда вокруг ее детища разгорелись новые споры. Она неоднократно выступала против переноса границы, предложенной ею еще в 1984 году. Главной проблемой, по ее мнению, была не только потенциальная травма, которую ученые могли нанести эмбрионам, но и отношение общества к пересмотру компромисса. Она опасалась усиления движений «за жизнь», «которые, похоже, не осознают, насколько активно ЭКО само по себе всегда было „за жизнь“». Уорнок подозревала, что попытки пересмотреть решение 1984 года позволят противникам ЭКО заявить, что «правило 14 дней» не было настоящим компромиссом и было предложено просто потому, что у ученых не было технической возможности его нарушить. В некотором смысле, конечно, это утверждение вполне может быть правдой.
В 2021 году ISSCR выпустил обновление своих рекомендаций, касающихся экспериментов со стволовыми клетками и эмбрионами. Пересмотрев правила и приняв во внимание новые научные данные, Общество отменило правило 14 дней. Больше нет четкой границы между допустимой и недопустимой продолжительностью эмбриональной жизни in vitro. Теперь эксперименты, включая длительное культивирование эмбрионов, попадают в «категорию B» правил, что подразумевает, что специальный комитет, состоящий из эмбриологов, биоэтиков и юристов, должен рассматривать предложение по каждому эксперименту отдельно и вырабатывать индивидуальное решение для каждого случая.
Пока неясно, решатся ли эти комитеты преодолеть правило 14 дней или будут придерживаться традиционной точки зрения. К сожалению, Мэри Уорнок не сможет увидеть, как будет развиваться эта история, поскольку она скончалась в 2019 году. Однако по мере того, как дебаты вокруг правила 14 дней становятся все более ожесточенными, другие области биологии приносят неожиданные открытия о том, что происходит внутри эмбриона именно на этом этапе развития.
Жизнь как старение
Другой способ определения жизни - не по тому, как она начинается, а по тому, когда она заканчивается. Можно воспринимать жизнь как путешествие в один конец, заканчивающееся смертью. С этой точки зрения организм может считаться живым, если он постоянно движется к смерти. В каком-то смысле жизнь можно считать синонимом старения.
Старение само по себе не имеет четкого определения. Его часто описывают как возрастное накопление пагубных изменений в организме, функциональный спад, завершение развития или другие процессы. Но эти способы описания старения не всегда приводят к надежным биомаркерам. Поэтому чаще всего используются различные прокси, такие как особенности накопления повреждений, омические часы, измеряющие биологический возраст (например, эпигенетические часы старения), общее бремя заболеваний или рост риска смертности.
До самого конца XX века эта параллель «жизнь-старение» была бесполезна для эмбриологов, поскольку невозможно было обнаружить какие-либо признаки старения внутри эмбриона - даже после того, как были разработаны технологии его культивирования in vitro. Только недавно, после того как были установлены различные надежные молекулярные биомаркеры старения, мы можем внимательнее присмотреться к ранним стадиям развития, чтобы определить, когда появляются первые признаки старения.
Во-первых, мы точно знаем, что некоторые признаки старения можно заметить уже через несколько недель развития. Яркий пример тому - однонуклеотидные вариации. Более трети точечных мутаций (в том числе онкогенных), возникающих в течение всей жизни нейрона, приобретаются до рождения, начиная, возможно, еще до закладки предшественников нейронов. Таким образом, если рассматривать накопление мутаций как признак старения, то жизнь должна начинаться где-то на первых делениях зиготы - с момента совершения ДНК-полимеразой первых ошибок.
Еще одна общая черта старения - растущий риск смерти. Давно известно, что этот риск минимален в период начала репродуктивной деятельности. Это согласуется с идеей о том, что старение начинается с завершением развития. Однако совсем недавно было показано, что минимальный уровень смертности приходится на возраст 9 лет, то есть до того, как человек может размножаться. Более того, исследования показали, что даже в этот момент и ранее «истинная» смертность, связанная со старением, маскируется высокой смертностью в начале жизни, связанной вместо старения с ошибками развития и очищающим отбором на пагубные мутации. Время, когда начинает проявляться связанная со старением смертность, определить действительно сложно, хотя считается, что она возникает где-то в первые месяцы развития.
В то же время можно утверждать, что старение не может начаться сразу после оплодотворения, поскольку должен существовать какой-то механизм, сбрасывающий возраст гамет. Было показано, что они накапливают различные признаки, связанные со старением (укороченные теломеры, агрегированные белки, измененное метилирование цитозина в ДНК и т. д.). Следовательно, должно пройти какое-то время, чтобы избавиться от этих признаков старения, и этот процесс, возможно, происходит после оплодотворения. Действительно, было показано, что теломеры действительно удлиняются в первые дни эмбрионального развития. Также было показано, что у некоторых видов животных после оплодотворения происходит процесс активного протеолиза, избавляющий бластомеры от потенциально токсичных агрегатов.
Недавно были разработаны прямые методы оценки биологического возраста ранних эмбрионов. Этот возраст можно определить с помощью эпигенетических часов старения, которые представляют собой биомаркеры, отражающие изменения в метилировании ДНК в определенных участках генома. Применение эпигенетических часов старения показало, что возраст бластоцист, эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток близок к нулю. Однако оказалось, что самый низкий возраст, который был назван нулевой точкой, не совпадает с оплодотворением или активацией собственного генома эмбриона. У мышей это состояние, с которого, как считается, начинается старение, соответствует примерно 7-10 дням после оплодотворения. У человека это состояние, по прогнозам, будет достигнуто на аналогичной стадии - после имплантации, примерно в период гаструляции.
Интересно, что эта нулевая точка старения человека вплотную прилегает к филотипической стадии эмбриогенеза позвоночных. Согласно модели песочных часов эволюции, самые ранние стадии развития не являются самыми консервативными. Период, когда все эмбрионы позвоночных наиболее похожи друг на друга (и экспрессируют гены, эволюционно наиболее древние), соответствует стадиям гаструляции и нейруляции, после которых растет разнообразие как в морфологии, так и в экспрессии генов. Таким образом, вполне вероятно, что нулевая точка старения заложена в эволюции и сохраняется у всех позвоночных. У человека она приходится на третью неделю после встречи яйцеклетки со сперматозоидом - на рубеже, установленном Мэри Уорнок и ее коллегами в 1984 году, или сразу после него.
Есть еще одно событие, происходящее в то же время, - это специализация примордиальных зародышевых клеток человека. Эти клетки имеют общую нулевую точку старения со всеми остальными клетками эмбриона, однако в дальнейшем они стареют по-разному, поскольку половые клетки могут стареть только настолько, чтобы иметь возможность полностью омолодиться в следующем поколении, в то время как соматические клетки могут стареть гораздо больше, если это максимизирует приспособленность. Таким образом, эмбриональную стадию можно рассматривать как начало соматической жизни, или рождение сомы - части, составляющей большую часть тела и подверженной развитию, старению и смерти. Это подтверждает мнение о том, что 14-дневная стадия является нулевой точкой старения. Таким образом, если старение можно считать неотъемлемой чертой жизни - по крайней мере, для соматических клеток, - то эту стадию можно рассматривать как начальную точку жизни для сомы.
14++
Отсутствие научного консенсуса по поводу начала жизни приводит нас к парадоксальной ситуации. Последнее решение ISSCR подразумевает, что - по крайней мере, до следующего обновления рекомендаций - какой бы момент мы ни считали началом человеческой жизни, и момент, когда мы принимаем на себя ответственность за эту жизнь, не будут совпадать. Первый момент полностью исключен из научных дискуссий (так как не существует корректного способа его определения), а второй будет устанавливаться каждый раз индивидуально. Мы снова оказываемся в ситуации, когда научные и этические соображения расходятся. Проблема установления новой границы экспериментов с эмбрионами потребует широкой дискуссии не только среди эмбриологов, но и биоэтиков, юристов и представителей различных социальных групп. Эта новая граница может не только отличаться в разных странах, но и развиваться вместе с отношением общества к подобным экспериментам, которое, несомненно, будет меняться со временем.
Наука о развитии человека, однако, идет своим путем. Где бы ни была установлена следующая граница, ученые остаются с биологическими фактами, накопленными вокруг предыдущей границы, а также с необходимостью ее дальнейшей концептуализации. Предотвращая будущие экспериментальные и концептуальные достижения, Комитет Уорнок был достаточно мудр, чтобы указать на уникальную стадию развития человека. Останется ли эта стадия законной и общепринятой границей для экспериментов или нет, теперь становится большим научным вопросом, поскольку она стала поворотным пунктом в эмбриогенезе.
Из того, что мы знаем на данный момент, эта стадия имеет несколько важных особенностей. Во-первых, она знаменует собой конечную точку процесса омоложения, который предположительно начинается через некоторое время после оплодотворения. Во-вторых, это нулевой момент, начало процесса старения на молекулярном уровне. В-третьих, этот этап устанавливает границу уникальности. До этого этапа отдельные эмбрионы могут легко объединяться и разделяться без влияния на дальнейшее развитие.
Однако определить эту стадию с точки зрения человеческой жизни довольно сложно, поскольку не существует хороших критериев для самой жизни. Все существующие на сегодняшний день определения оказались непоследовательными или противоречивыми, когда дело дошло до практики и клинического использования. Поэтому вместо определения человеческой жизни в целом мы можем сосредоточиться на этапах, которые знаменуют появление различных уровней организации жизни. Так, можно рассмотреть клеточный уровень (когда эмбрион можно рассматривать как живую систему), организменный уровень (момент, когда группа клеток может рассматриваться как основа нового организма) и уровень человеческой жизни (рубеж, который знаменует признание эмбриона человеком).
Эти уровни организации могут возникать в разные моменты времени, а некоторые из них могут совпадать. Базальный клеточный уровень жизни может вообще не иметь границы (пока мы не научимся создавать синтетические клетки), так как не существует момента, когда гамета или формирующийся эмбрион перестают быть живой системой, по крайней мере в плане метаболизма. Верхняя граница - уровень человека - станет предметом дальнейших дискуссий с участием ученых и биоэтиков.
Нас же больше всего интересует промежуточный, организменный уровень. Сроки перехода от скопления клеток к организованной структуре не очевидны, хотя мы предполагаем, что 14-дневная стадия может быть хорошим кандидатом на эту точку. Именно на этой стадии эмбрион начинает проявлять признаки дискриминации «я/не я». Клетки организованы в слои, образующие черновой план тела, и эту структуру нелегко разделить на части. Наконец, все эти клетки закончили процессы омоложения, и некоторые из них - а именно сома - уже начали стареть. Таким образом, эту многослойную структуру теперь можно рассматривать как живой организм, который еще не обладает всеми человеческими атрибутами (и даже может не стать человеком, например, в случае летальных мутаций или хромосомных аномалий), но уже обрел свои границы и начал новый цикл старения-омоложения.
Однако последние исследования синтетических эмбрионов придают этой гипотезе новое измерение. Эти достижения открывают новые возможности наблюдать зарождение жизни в организме in vitro, изучить молекулярные процессы, лежащие в основе этого перехода, и выяснить, является ли он необходимым для развития человека.
Становление человека in vitro
До недавнего времени стадию 14 дней невозможно было воспроизвести in vitro даже на животных моделях. Во время прорывного эксперимента по эктогенезу мышей эмбрионы начинали свое развитие в матке и извлекались для продолжения роста in vitro только после имплантации. Однако сейчас нескольким группам удалось преодолеть это ограничение: их исследования показали, что развитие эмбриона мыши может быть воспроизведено вплоть до 8-го дня, то есть за пределами гаструляции. А за последний год аналогичные успехи были достигнуты и в случае с человеческими эмбрионами.
Первые модели человеческих эмбрионов, например гаструлоиды, не полностью повторяли черты настоящего эмбриона и не могли называться человеческими эмбрионами. Позже появилось несколько работ, направленных на создание синтетических эмбрионов из плюрипотентных клеток. В результате были получены бластоиды, которые имели определенное сходство с естественными бластоцистами, однако было неясно, способны ли они переходить на дальнейшие стадии развития.
В 2023 году было опубликовано несколько сообщений с описанием сложных моделей, которые, по утверждениям их создателей, содержали определенные типы клеток и структур, характерных для 14-дневной стадии. Например, Ai et al. сообщили о наличии примитивных полосатых клеток-предшественников в своих E-ассемблоидах, Pedroza et al. обнаружили примитивные полосатые клетки в своих экстраэмбриоидах, а Oldak et al. описали появление клеток-предшественников зародышевой линии, амниона, желточного мешка, хориальной полости и даже рудиментарного пупочного канатика в своей модели эмбриона стволовых клеток.
Ни один из этих экспериментов не длился дольше 14 дней, и исследователи не ставили целью вырастить свои синтетические структуры дальше стадии примитивной полоски. Однако, учитывая достижения в области мышиного эктогенеза, можно предположить, что в следующий раз кто-то попытается провести эксперимент по выращиванию в течение более длительного времени. Таким образом, возникает вопрос, можно ли называть эти клеточные конструкции эмбрионами, обращаться с ними как с настоящими эмбрионами и подчиняться ограничениям, наложенным Комитетом Уорнок или последними рекомендациями ISSCR.
Каждая из этих эмбриональных моделей имела определенные отличия от настоящих человеческих эмбрионов соответствующей стадии Карнеги. В некоторых из них отсутствовали определенные типы клеток, у других форма была иной. Поразительно, но во всех моделях отсутствовали полностью развитые внеэмбриональные ткани. Хотя большинство синтетических эмбрионов смогли развить амниотическую полость, а некоторые из них продвинулись дальше и вырастили желточный мешок, ни у одного из них не было полноценного трофобласта (это может быть связано с тем, что экспериментальная установка не включала надлежащую ткань матки). Таким образом, эти синтетические эмбрионы не способны к самостоятельному развитию, даже если их перенести в суррогатную матку, хотя это не означает, что они не смогут развиваться дальше в лабораторных условиях. Таким образом, необходимы новые критерии, позволяющие отличить живой человеческий эмбрион от кучки синтетических клеток.
После публикации этих отчетов группа исследователей из Кембриджа, среди которых были ученые и эксперты по биоэтике, задалась целью доработать эти критерии. Недавно сформированный проект Governance of Stem Cell-Based Embryo Models (G-SCBEM) был нацелен на разработку новой системы исследований эмбрионов, которая бы включала в себя проблему работы с синтетическими моделями эмбрионов.
Пока эта работа еще продолжается, Rivron et al. предложили новое определение эмбриона. Согласно ему, чтобы считаться эмбрионом человека, модель должна представлять собой
«группу человеческих клеток, поддерживаемых элементами, выполняющими внеэмбриональные и маточные функции, которые в совокупности имеют потенциал для формирования зародыша».
Эта формула не требует, чтобы эмбрион-кандидат имел схожую структуру с настоящим эмбрионом или содержал все характерные типы клеток. Кроме того, это определение не подразумевает, что эмбрион должен пройти все стадии развития с 1-го по 14-й день. Независимо от истории жизни, группа человеческих клеток может считаться эмбрионом, как только она обретает возможность выполнять все необходимые функции. Это отражает то, что исследователи увидели в своих моделях эмбрионов: некоторые из синтетических структур миновали стадию бластоцисты и развились сразу на 9-10 день нормального развития.
Это подводит нас к следующему вопросу: можно ли миновать и 14-дневную стадию, объединив несколько эмбриональных слоев? Это может стать не только технической задачей, но и проверкой ключевой гипотезы - является ли эта временная точка критической границей для самоорганизации клеток внутри развивающегося эмбриона. Может случиться так, что создание синтетического эмбриона более поздних стадий развития окажется слишком сложной задачей, поскольку потребует производства и сборки слишком большого количества типов клеток. Однако если после 14 дней эмбрион все-таки будет получен (по крайней мере, у мышей), было бы интересно проверить его жизнеспособность. Если окажется, что он способен к полноценному развитию, это будет означать, что нулевую точку старения можно будет избежать.