Согласно исследованию, проведенному учеными из Университета Токио, нижний сегмент иммуноглобулина G (IgG) действует как центр структурного и функционального контроля.
Удаление единственной аминокислоты в этом участке превращает полноразмерное антитело в стабильную половину молекулы IgG1 с измененной иммунной активностью. Полученные результаты дают основу для разработки антител нового поколения с точно подобранными иммунными эффектами для лечения таких заболеваний, как рак и аутоиммунные заболевания.
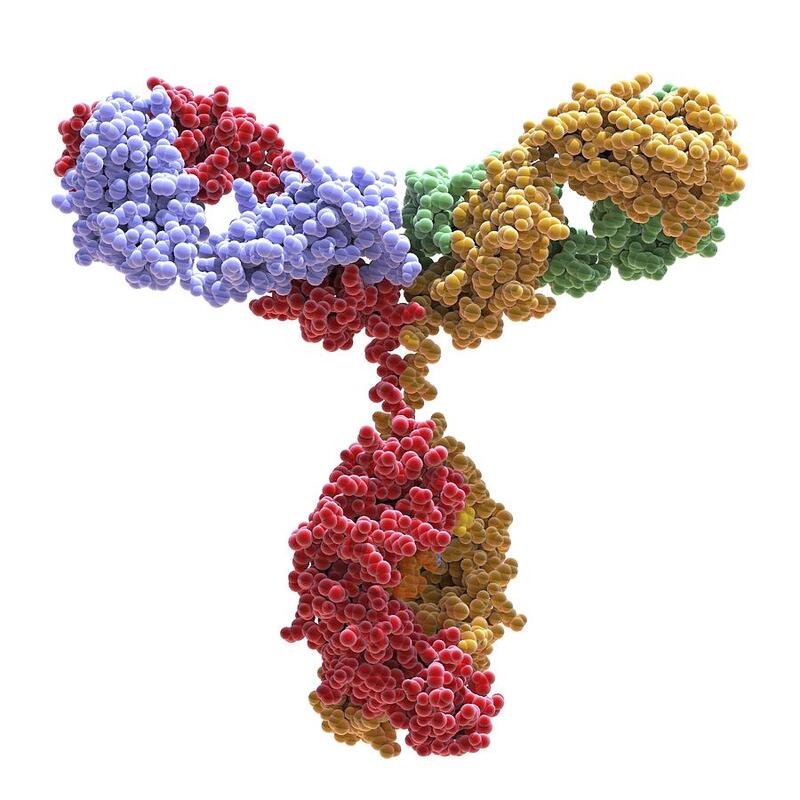
Антитела - это Y-образные белки, которые помогают иммунной системе распознавать и устранять чужеродные угрозы, такие как бактерии и вирусы. Доминирующими антителами в крови являются иммуноглобулины G (IgG), на долю которых приходится около 75% циркулирующих антител. IgG - это многофункциональный гликопротеин, необходимый для иммунной защиты и широко используемый в качестве терапевтического средства благодаря своей антигенной специфичности и эффекторным функциям. IgG разделен на два основных функциональных блока, соединенных гибким шарниром, которые должны работать вместе. Однако присущая ему гибкость шарнирной области усложняет структурную характеристику и скрывает молекулярную основу механизма его действия. Статья, опубликованная недавно в журнале Journal of Medicine Chemistry, показывает, что удаление одной аминокислоты в нижней части антитела может кардинально изменить его структуру и иммунную сигнализацию.
Антитело IgG состоит из трех основных структурных компонентов. Два ответвления, известные как Fab-области, связываются со специфическими антигенами, в то время как Fc-область, похожая на ствол, соединяет их и передает сигналы иммунной системе. Ответвления Fab соединяются со стержнем Fc коротким сегментом, называемым шарниром. Шарнир IgG имеет "мозаичную" конструкцию с жестким центральным сердечником, который удерживает две тяжелые цепи вместе с помощью дисульфидных связей, окруженных более гибкими верхним и нижним сегментами шарнира. Несмотря на небольшие размеры, шарнир играет важную роль, позволяя различным частям антитела двигаться вместе. Он обеспечивает достаточную гибкость для адаптации ответвлений антител, позволяя эффективно захватывать мишень и поддерживать иммунную сигнализацию.
Предыдущие исследования были в основном сосредоточены на том, как изменения в верхнем сегменте шарнира и центральном ядре влияют на функцию антител. Чтобы исследовать влияние мутаций в нижнем сегменте шарнира, ученые проводили систематические аминокислотные замены в области шарнира трастузумаба, хорошо известного гуманизированного антитела IgG1, используемого для борьбы с белком HER2 в терапии рака. Удалив единственный остаток пролина (Pro230), исследователи наблюдали образование антител половинного размера массой 75 кДа, известных как half-IgG1. В такой конфигурации структура дисульфидных связей нарушалась и две тяжелые цепи больше не были стабильно связаны.
Визуализационные исследования показали, что относительная ориентация областей Fab и Fc изменилась. В нормальном IgG-антителе Fc область расположена таким образом, что позволяет двум ее половинкам соединяться и взаимодействовать с иммунными рецепторами. В половинном антителе эта поверхность соединения была повернута внутрь по направлению к Fab-области. Такое необычное расположение, вероятно, приводит к физическому взаимодействию плеч Fab, препятствуя формированию нормального димера в области Fc.
Несмотря на это нарушение, полуантитело не было полностью неактивным. Оно сохранило способность связываться с высокоаффинным иммунным рецептором FcγRI через единый интерфейс. Поскольку FcγRI может взаимодействовать с антителами с высокой аффинностью, даже молекула, состоящая из половины IgG, все равно может запускать иммунную сигнализацию, хотя и менее эффективно, чем полноразмерное антитело.
В совокупности эти результаты показывают, что нижний шарнир играет решающую роль в поддержании формы, стабильности и функции антител, что позволяет исследователям описать его как "центр структурного и функционального контроля" в IgG1, обладающий потенциалом для разработки терапевтических антител с индивидуальными иммунными эффектами. Эти результаты переосмысливают роль шарнирной области и дают основу для разработки вариантов антител с индивидуальными профилями эффекторов для лечения аутоиммунных заболеваний, рака и других заболеваний.