Моника Коэнраадс признается, что будучи начинающей мамой и не проводя много времени рядом с детьми, она не сразу заметила, что с ее дочерью Челси что-то не так.
Однако к тому времени, когда Челси исполнился год, ее развитие явно затормозилось и даже пошло вспять. Она научилась говорить только одно слово и вскоре перестала что-либо произносить. Челси могла ходить, только если кто-то держал ее за руку. Она потеряла способность хватать и вместо этого начала «делать повторяющиеся движения руками», например хлопать, рассказывает Коэнраадс. «Я отчаянно нуждалась в диагнозе», - рассказала Коэнраадс. Но когда она наконец получила его, когда Челси было 2 года, «это был двойной удар». Мало того, что у Челси был синдром Ретта, не поддающееся лечению неврологическое расстройство, ученые мало что знали об этом заболевании. Они понимали, что оно поражает в первую очередь девочек и, скорее всего, вызвано мутацией, но не могли определить генетического виновника.
Это было в 1998 году. Сегодня Коэнраадс и ее муж по-прежнему ухаживают за 28-летней Челси, которая не может говорить, ходить или пользоваться руками. Ей требуются лекарства, чтобы подавить припадки, уменьшить беспокойство и помочь уснуть. Генетические сбои, лежащие в основе заболевания, теперь известны: обычно это мутации в гене MECP2, который контролирует активность генов во многих органах, включая мозг. Как и другие родители детей с синдромом Ретта, Коэнраадс хотел бы, чтобы ученые поторопились с разработкой лечения. Но как основатель и генеральный директор Фонда исследований синдрома Ретта, она также в состоянии что-то сделать для этого.
Помимо финансирования целого ряда стратегий по исправлению или замене дефектной ДНК ее организация поддерживает нетрадиционный подход. Фонд выделил 8,5 миллиона долларов - более 10% всех средств, выделенных на исследования, - на усилия по редактированию РНК, которые кодируют мутировавший MECP2. Тем самым они укрепляют зарождающийся, но многообещающий подход к лечению болезней: редактирование РНК-чертежей белков. «Наша цель - внести новшества в эту область», - говорит Коэнраадс.
Она не единственная, кто с энтузиазмом относится к возможностям редактирования РНК. Эта альтернатива генному редактору CRISPR и другим методам модификации ДНК «выходит на первый план», - считает биоинженер Томас Гадж из Университета Иллинойса. Отредактированные РНК легче доставлять в клетки, чем препараты на основе ДНК, к тому же эта стратегия может быть более безопасной.
Пока что для лечения синдрома Ретта не разработано ни одного метода редактирования РНК. Но на прошлой неделе компания Wave Life Sciences объявила, что ее метод редактирования РНК увеличил производство нормального белка у людей с опасным для жизни генетическим заболеванием, которое повреждает печень и легкие. Кроме Wave и еще три компании - Scidian Therapeutics, Rznomics и HuidaGene - начали тестировать лечение на пациентах с заболеваниями глаз или раком. Еще больше компаний пытаются разработать собственные методы лечения, часто в партнерстве с компаниями «Большой Фармы», а академические лаборатории углубляются в изучение механизмов редактирования.
Редактирование РНК - это «не CRISPR. Это еще одно новое оружие против заболеваний», - поясняет биоинженер Джонатан Гутенберг из Гарвардской медицинской школы, чья лаборатория разработала новые подходы к изменению РНК. Исследователи все еще работают над совершенствованием технологии по нескольким направлениям: повышают ее эффективность и точность, улучшают способы доставки необходимых молекул и уменьшают побочные эффекты. По словам биоинженера Аравинда Асокана из Медицинской школы Университета Дьюка, выбор правильных заболеваний также имеет решающее значение. «Все сводится к тщательному выбору области применения».
Для многих людей новые вакцины против COVID-19, основанные на РНК, воскрешают в памяти школьные уроки биологии, где они узнают, что двухцепочечная ДНК гена всего лишь хранит инструкции по созданию белка. Чтобы собрать белок, клетки транскрибируют ген в мессенджерную РНК (мРНК), которая передает чертеж белка крошечным молекулярным фабрикам - рибосомам, которые соединяют аминокислоты между собой, создавая белок. Синтетическая мРНК в вакцинах COVID-19 использует эту биологию, чтобы обмануть клетки и заставить их производить вирусные белки, которые стимулируют иммунитет.
По меньшей мере дюжина одобренных методов лечения генетических заболеваний, включая один, основанный на CRISPR, изменяет ДНК человека. Эти методы лечения направлены на борьбу с серповидно-клеточной анемией, одним из видов мышечной дистрофии и некоторыми другими заболеваниями. В настоящее время разрабатываются методы лечения множества других заболеваний с помощью ДНК-модификации - только стратегии на основе CRISPR проходят более 40 клинических испытаний. Однако «внесение генетических изменений в РНК вместо ДНК имеет ряд огромных преимуществ», - утверждает молекулярный биолог Джошуа Розенталь из Чикагского университета, один из основателей компании Korro Bio, занимающейся редактированием РНК.
Во-первых, редактирование мРНК не сопряжено с риском неправильного изменения генов человека, которое может стать необратимым. Напротив, поскольку измененные РНК быстро разрушаются в организме, результаты редактирования носят временный характер, что облегчает прекращение терапии и уменьшение побочных эффектов. Это делает редактирование РНК более похожим на другие медикаменты. «Большинство методов лечения не являются постоянными», - говорит Розенталь. «Вы же не принимаете постоянно аспирин».
Кроме того, CRISPR использует бактериальные ферменты, такие как Cas9, для разрезания ДНК, а они могут спровоцировать иммунную систему. «Там у вас чужеродный белок, который вы помещаете внутрь человеческих клеток», - говорит биоинженер Прашант Мали из Калифорнийского университета. Некоторые подходы к редактированию РНК, которые разрабатывают исследователи, позволяют избежать этого риска.
Редактирование РНК происходит в клетках естественным образом.
Например, мРНК начинаются как более длинные черновики, известные как пре-мРНК, а затем клетки обрезают последовательности, которые не кодируют участки белков. Впервые ученые предложили использовать эти механизмы РНК-модификации для борьбы с заболеваниями в середине 1990-х годов, но у них не было необходимых инструментов для этого. Теперь, после двух десятилетий развития генетических технологий и других методов лечения на основе РНК, таких как малые интерферирующие РНК (siRNAs) и антисмысловые РНК, которые снижают производство вредных белков, редактирование РНК может стать реальностью.
Многие из разрабатываемых сейчас методов лечения задействуют клеточный механизм, который настраивает РНК таким образом, чтобы она не провоцировала нашу иммунную систему. Хотя мРНК начинаются с одной нити, «все РНК сворачиваются и ничего с этим не поделаешь», - говорит биохимик Бренда Басс из Университета Юты. Когда эти молекулы складываются вдвое, они могут включить клеточную сигнализацию против вирусов, которые также часто содержат двухцепочечные РНК, и вызвать воспаление.
Как обнаружили Басс и ее коллеги в конце 1980-х годов, клетки часто заменяют один строительный блок в молекулах мРНК, аденозин, на другую молекулу, известную как инозин. Эта замена маркирует клеточные РНК как не представляющие угрозы. Поскольку эти преобразования A в I, как их называют ученые, часто происходят в тех частях молекул мРНК, которые не кодируют части белка, они обычно не влияют на конечную последовательность аминокислот. Однако «без них у всех были бы аутовоспалительные заболевания», - поясняет Басс.
Ферменты, известные как ADARs (от adenosine deaminases acting on RNA), осуществляют переключение с A на I. Методы редактирования РНК, которые задействуют эти ферменты, многообещающи, поскольку многие наследственные заболевания возникают из-за генных мутаций, которые меняют другой строительный блок, гуанозин, на аденозин в определенных местах молекулы мРНК. Заменяя аденозин на инозин, ADAR могут, по сути, исправить ошибку, поскольку механизм производства белков в клетке считывает инозин в мРНК как гуанозин. Чтобы задействовать ADAR, исследователи создают направляющую РНК - короткую нить, последовательность которой дополняет последовательность части мРНК, на которую они хотят нацелиться. Эта синтетическая последовательность, известная как олигонуклеотид, распознает и связывается с участком мРНК, несущим аденозин, который нужно заменить, образуя двухцепочечную структуру, которая притягивает корректирующий фермент.
Помимо исправления мутаций, исследователи надеются использовать ADAR для изменения функций белков. Замена аденозинов в мРНК может включать или выключать полученный белок, изменять его взаимодействие с другими белками, менять его расположение в клетке, ускорять или замедлять его распад. Биотехнологическая компания ProQR Therapeutics намерена использовать этот подход для лечения холестатических расстройств - группы заболеваний, при которых желчные кислоты, вырабатываемые печенью, накапливаются в этом органе, повреждая его.
ProQR сосредоточилась на рецепторе, который пропускает желчные кислоты в гепатоциты - самые многочисленные клетки печени. Исследователи разработали направляющую РНК, которая находит участок мРНК рецептора, содержащий важный аденозин. Затем ADAR меняет его на инозин, который блокирует рецептор и «может избавить гепатоциты от перегрузки или наводнения желчными кислотами», - рассказывает Жерар Платенбург, главный научный сотрудник ProQR. Компания планирует начать испытания своих олигонуклеотидов в конце этого года или в начале 2025 года, сообщил Платенбург.
Клиническое испытание, которое принесло хорошие новости на прошлой неделе, также связано с терапией редактирования A-на-I. Компания Wave нацелилась на борьбу с дефицитом ААТ, который проявляется в недостатке или дефекте альфа-1-антитрипсина - белка, нейтрализующего вредные ферменты, выделяемые иммунными клетками. Нехватка этой молекулы делает легкие уязвимыми для разрушительных иммунных ферментов. Дефицит ААТ может нарушить работу легких уже к 20 годам, а дефектный ААТ застревает в клетках печени, что приводит к циррозу и другим видам ее поражения. Если не лечить симптомы, болезнь может привести к ранней смерти. Новая терапия представляет собой инъекцию олигонуклеотидов, которые нацеливаются на участок мРНК, мутировавший почти у 95% пациентов с тяжелым дефицитом ААТ.
В прошлом году компания Wave начала тестирование безопасности своего препарата на здоровых людях, а затем перешла к людям, унаследовавшим две плохие копии гена ATT и не производящим нормальную версию белка. Компания сообщила, что у двух пациентов, получивших одну дозу терапии, через 15 дней более 60% белка AAT в крови составляла нормальная версия. Эта версия все еще присутствовала в их крови через 57 дней после лечения. «Уровень редактирования мРНК, который мы наблюдаем при приеме одной дозы, превзошел наши ожидания, и мы рассчитываем, что при повторном приеме препарата уровень [нормального белка] продолжит расти», - заявил в своем релизе президент и генеральный директор компании Пол Болно. Ученые, работающие в этой области, положительно оценивают результаты исследования, хотя для полной оценки терапии потребуется больше времени и гораздо больше данных. «Это, безусловно, важная веха в области редактирования РНК, подтверждающая, что ADAR-опосредованное редактирование РНК может быть использовано в терапевтических целях», - говорит Мали.
Еще до появления новостей от компании Wave Розенталь был столь же оптимистичен в отношении того, какой из методов редактирования РНК первым получит одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. "Если бы мне нужно было предсказать, кто будет первым, то я бы сказал это про «A-на-I»", - говорит он. Но исследователи все еще изучают, как повысить эффективность ADAR и предотвратить ошибочные изменения, которые могут привести к побочным эффектам. Например, они обнаружили, что химическая настройка направляющих РНК может повысить эффективность редактирования. В олигонуклеотиде Wave используется модифицированная версия основания урацил, но и другие модификации могут принести пользу. В исследовании 2022 года, проведенном Мали и коллегами, было показано, что направляющие РНК, концы которых соединены в петлю, могут повысить эффективность редактирования в культивируемых человеческих клетках и у мутантных мышей, имитирующих человеческое метаболическое заболевание. Кроме того, кольцевые РНК дольше сохраняются в клетках, вероятно, потому, что они менее уязвимы для естественных ферментов, разрушающих РНК.
Исследователи также пытаются сократить количество нецелевого редактирования, при котором ADAR пропускают нужные аденозины и вместо этого изменяют соседние. Группа под руководством химика Питера Била из Калифорнийского университета показала, что размещение определенных нуклеотидов в определенных местах направляющей РНК может защитить «невинные» аденозины. Прочные молекулы, известные как запертые нуклеиновые кислоты, являются эффективными телохранителями для аденозинов. «Мы можем контролировать селективность реакции, стратегически располагая эти запертые нуклеиновые кислоты», - говорит Бил.
В принципе, ADAR могут исправить около 20 000 мутаций гуанозина в аденозин, которые приводят к генетическим заболеваниям. В это число входят дефекты, ответственные примерно за треть случаев синдрома Ретта, говорит Коэнраадс. Но одно из ограничений этого подхода заключается в том, что исследователям приходится разрабатывать и тестировать направляющую РНК для каждой мутации. «Как можно лечить их все?» - задается вопросом биоинженер Омар Абудайе из Гарвардской медицинской школы. Кроме того, ADAR мало чем помогут в случае более чем 100 000 других генетических сбоев, вызывающих заболевания, которые могут включать в себя однонуклеотидные изменения, которые ферменты не могут исправить, или более крупные дефекты, такие как увеличение или потеря целых сегментов ДНК.
Чтобы разобраться с этим широким миром мутаций, Абудайе, его коллега Гутенберг и другие ученые пытаются задействовать другой механизм изменения РНК, известный как сплайсинг, который происходит естественным образом. В ходе этого процесса клетки редактируют молекулу пре-мРНК, удаляя ненужные участки, называемые интронами, и сшивая оставшиеся последовательности, называемые экзонами. Чаще всего клетки соединяют экзоны из одной и той же молекулы пре-РНК, чтобы получилась мРНК. Однако иногда механизм сплайсинга соединяет часть молекулы пре-мРНК для другого белка - этот маневр известен как транс-сплайсинг, в результате которого получается составная мРНК.
Исследователи надеются, что, запустив транс-сплайсинг они смогут заменить большие участки дефектных мРНК на исправленную последовательность. Таким образом, изменение РНК может лечить заболевания, вызванные различными мутациями. Возможно, что «одним препаратом можно будет охватить всех, у кого есть мутация в этом гене», - говорит Абудайе. Компания Ascidian, названная в честь группы морских организмов, в которых широко распространен транс-сплайсинг, начала этим летом клинические испытания, чтобы проверить, сможет ли этот механизм замедлить прогрессирование болезни Штаргардта - наследственного варианта макулярной дегенерации, вызванного дефектами в гене ABCA4, белок которого помогает защищать глаза от токсинов.
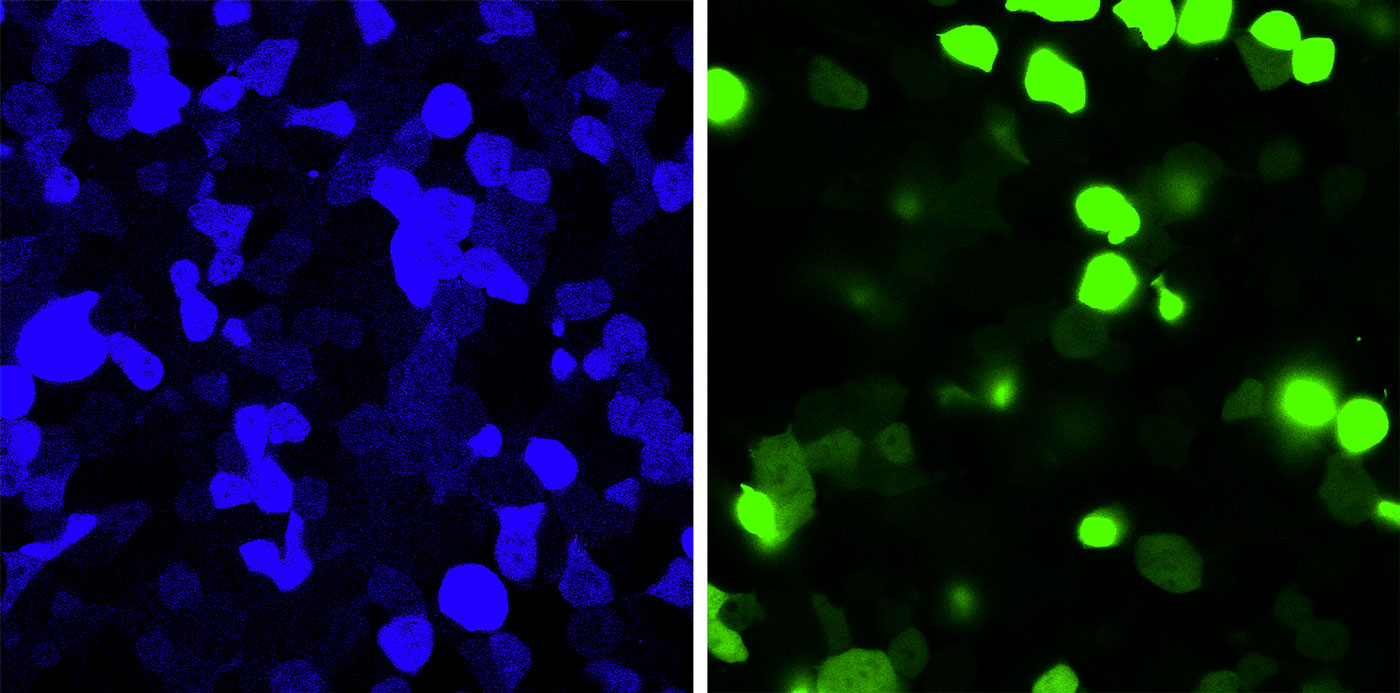
В эксперименте на клетках мутация превратила обычно зеленый флуоресцентный белок в синий (слева). Редактирование мессенджерной РНК восстанавливает нормальный цвет (справа). Фото: Toshifumi Tsukahara/Japan advanced institute of science and technology
Более 1000 мутаций могут вызывать болезнь Штаргардта и лечение «может помочь примерно 75% пациентов», - говорит Майкл Элерс, президент Ascidian. В ранних исследованиях стратегия повышала уровень нормального белка ABCA4 в глазах обезьян и в образцах тканей сетчатки человека. По утверждению Элерса, чтобы определить, поможет ли она людям, потребуется около 2 лет, поскольку заболевание прогрессирует очень медленно.
Южнокорейская компания Rznomics также проводит два клинических испытания транс-сплайсинга в качестве лечения рака печени и мозга. В следующем году она начнет исследование терапии наследственного заболевания глаз - пигментного ретинита, при котором пациенты постепенно теряют зрение из-за разрушения клеток сетчатки.
У сплайсинга TraNS есть проблема эффективности: в некоторых исследованиях процедура исправляла менее 1% дефектных мРНК. Чтобы увеличить этот показатель, исследователи изучают несколько стратегий, включая использование бактериальных Cas-белков, несмотря на риск вызвать иммунную реакцию. Асокан с коллегами, например, обратились к ферменту Cas13, который измельчает РНК, а не ДНК. Они изменили белок так, чтобы он не мог делать разрезы, превратив его в соединитель, который соединяет естественную пре-мРНК, готовую к сплайсингу, с введенной молекулой РНК, несущей замещающие экзоны. В культивируемых клетках этот подход оказался в 40 раз эффективнее, чем альтернативный, который полагался на направляющую РНК, чтобы направить исправленную последовательность в нужное место, сообщили исследователи в марте в журнале Nature Communications.
В отличие от этого, Абудайе, Гутенберг и коллеги воспользовались способностью другого белка Cas резать РНК. Они предположили, что, отрезая молекулу пре-мРНК в определенном месте сплайсинга, фермент Cas7-11 облегчит добавление альтернативных экзонов РНК. Исследователи протестировали методику на различных клетках, включая линии, несущие мутации, вызывающие заболевания. Эффективность транс-сплайсинга увеличилась от 5 до 50%, о чем они сообщили ранее в этом году в препринте bioRxiv.
Белки Cas также могут редактировать мутировавшие мРНК, просто разрезая их, что обычно приводит к их дегенерации, снижая уровень аномальных белков, вызывающих заболевания. Клинические испытания, спонсируемые китайской биотехнологической компанией HuidaGene, позволят выяснить, приносит ли эта стратегия пользу людям с заболеванием глаз - возрастной макулярной дегенерацией или синдромом дупликации MECP2 - неврологическим расстройством и расстройством развития, обратным синдрому Ретта - слишком высокий уровень MECP2.
Однако быть разрезанной Cas не всегда означает гибель для молекулы РНК. Иногда клетки спасают разорванную РНК и вновь соединяют концы. Молекулярный биолог Блейк Виденхефт из Университета штата Монтана и его коллеги хотят использовать этот естественный процесс восстановления РНК, полагая, что с помощью белков Cas можно вырезать проблемные участки мРНК. После этого клетки будут восстанавливать молекулу, оставляя немного более короткую, но функциональную мРНК.
Исследователи проверили эту стратегию на клетках, несущих одну из мутаций, которая приводит к муковисцидозу. Это изменение создает преждевременный сигнал «стоп» в мРНК для белка CFTR, заставляя клетки производить усеченную версию молекулы, которая быстро разрушается. В результате у пациентов возникает дефицит CFTR, который регулирует содержание соли и жидкости в легких. Работая с культивируемыми клетками, исследователи использовали белок Cas и направляющую РНК, нацеленную на сигнал остановки РНК, чтобы удалить мутировавший участок из мРНК CFTR. Хотя большинство отредактированных мРНК разрушились, некоторые из них восстановились, и клетки начали вырабатывать CFTR почти в полном размере, сообщает исследовательская группа в журнале Science от 17 мая.
По словам Виденхефта, этот подход не подходит для некоторых белков, которые не могут функционировать без удаленного участка. Но другие могут работать просто отлично. Он основал компанию, чтобы попытаться превратить полученные результаты в терапию. По его словам, муковисцидоз, вероятно, не является подходящей мишенью для терапии по разным причинам, но другие 45 генетических заболеваний - вполне.
Область редактирования РНК «находится в самом начале своего развития», - считает Гадж, - и «скорее всего, будет испытывать трудности роста». Один из вопросов, над которым бьются исследователи, - как доставить молекулы РНК-редактирования в нужные органы и клетки, - проблема, которая также мешает стандартным генным терапиям и редактированию ДНК. «Доставка - самое большое препятствие для РНК-редактирования», - отмечает Мали.
Чтобы доставить РНК-редакторы к цели, исследователи часто упаковывают их в аденоассоциированные вирусы, которые уже используются для доставки целых генов или CRISPR-терапии. Такова стратегия компании Ascidian для лечения болезни Штаргардта. Ученые также используют липидные наночастицы того же типа, что и для мРНК-вакцин. В отличие от них, олигонуклеотиды Wave вводится в организм, покрытые только углеводом, который позволяет им проникать в клетки печени. Каждый из этих методов имеет свои преимущества и недостатки, поэтому могут потребоваться новые стратегии.
Исследователи также опасаются, что низкая эффективность методов редактирования РНК будет сдерживать лечение. Но такие редакторы ДНК, как CRISPR, были столь же неэффективны на заре своего существования. И даже лечение, которое восстанавливает лишь небольшую часть мРНК, все равно может принести пользу пациентам, отмечает Бил. «Для получения терапевтического эффекта достаточно всего лишь пары процентов».
Подходы к редактированию РНК сталкиваются с конкуренцией не только со стороны уже существующих генетических средств на основе ДНК, но и со стороны других методов лечения, в которых задействована РНК. Уже существует шесть одобренных методов лечения с помощью siRNA и 18 препаратов на основе олигонуклеотидов, и все они снижают уровень мутантных мРНК, а не исправляют молекулы. Тем не менее, исследователи считают, что РНК-редактирующие методы лечения могут найти свою нишу. Если это произойдет, то людям, получающим такую терапию, будет все равно, на какую ДНК или РНК она воздействует, говорит Гутенберг. «Для большинства пациентов не имеет значения, как лечится их заболевание. Важно, что оно излечивается».

