Вирусы конкурируют друг с другом за ограниченные клеточные ресурсы и некоторые из них создают оборонительные механизмы, которые защищают хозяина от конкурирующих генетических паразитов.
Непрекращающаяся гонка вооружений между бактериями и фагами привела к развитию различных врожденных и адаптивных иммунных систем бактерий и антииммунных систем фагов. В то же время фаги иногда могут играть на стороне хозяина и кодировать иммунные системы, которые помогают им конкурировать с другими фагами. Одной из таких иммунных систем является PARIS (Phage Anti-Restriction-Induced System - Фаговая система, индуцируемая антирестрикцией). PARIS - одна из новых иммунных систем, образующих макромолекулярные комплексы для распознавания чужеродных белков, но не чужеродных нуклеиновых кислот. PARIS включает в себя два компонента - сенсор AriA и токсин/эффектор AriB. Система активируется белком Ocr (Overcoming classical restriction), который имитирует структуру ДНК и, связываясь с ДНК-распознающими иммунными белками, помогает фагу избежать действия систем рестрикции-модификации и защитной системы BREX (BacteRiophage EXclusion).
Группа ученых из Российского Сколковского института науки и технологий (Сколтеха), США и Франции выяснила механизм работы системы PARIS и представила результаты в недавней статье в журнале Nature. «Система PARIS, с нашей точки зрения, особенная, потому что она напрямую демонстрирует коэволюцию бактерий и фагов. Она является связующим звеном между антииммунными белками и бактериальным иммунитетом. Бактерии имеют более 150 иммунных систем, а это значит, что фаги тоже должны адаптироваться к ним и кодировать различные антииммунные белки. PARIS - это своего рода контрмера со стороны бактерий, позволяющая им защищаться от фагов, которые уже эволюционировали, чтобы подавлять другие иммунные системы", - рассказал соавтор исследования и руководитель лаборатории метагеномного анализа Биоцентра Сколтеха Артем Исаев.
«Кроме того, PARIS может распознавать вирусную инфекцию по наличию в клетке вирусных белков, а не вирусной ДНК, что напоминает принцип антиген/антитело, характерный для эукариотического иммунитета. В последние годы было открыто множество подобных систем (~AVAST, CapRel, Thoeris и др.). В то же время, когда в клетке появляются вирусные белки, это часто сигнализирует о том, что инфекция зашла уже достаточно далеко и системы, специфичные для деградации фаговой ДНК, не справились с задачей. В этих условиях эффективной стратегией защиты становится программируемая клеточная смерть, которая останавливает развитие вирусной инфекции на популяционном уровне. Нам удалось расшифровать механизм такой «программы самоубийства» для системы PARIS», - пояснил Исаев.
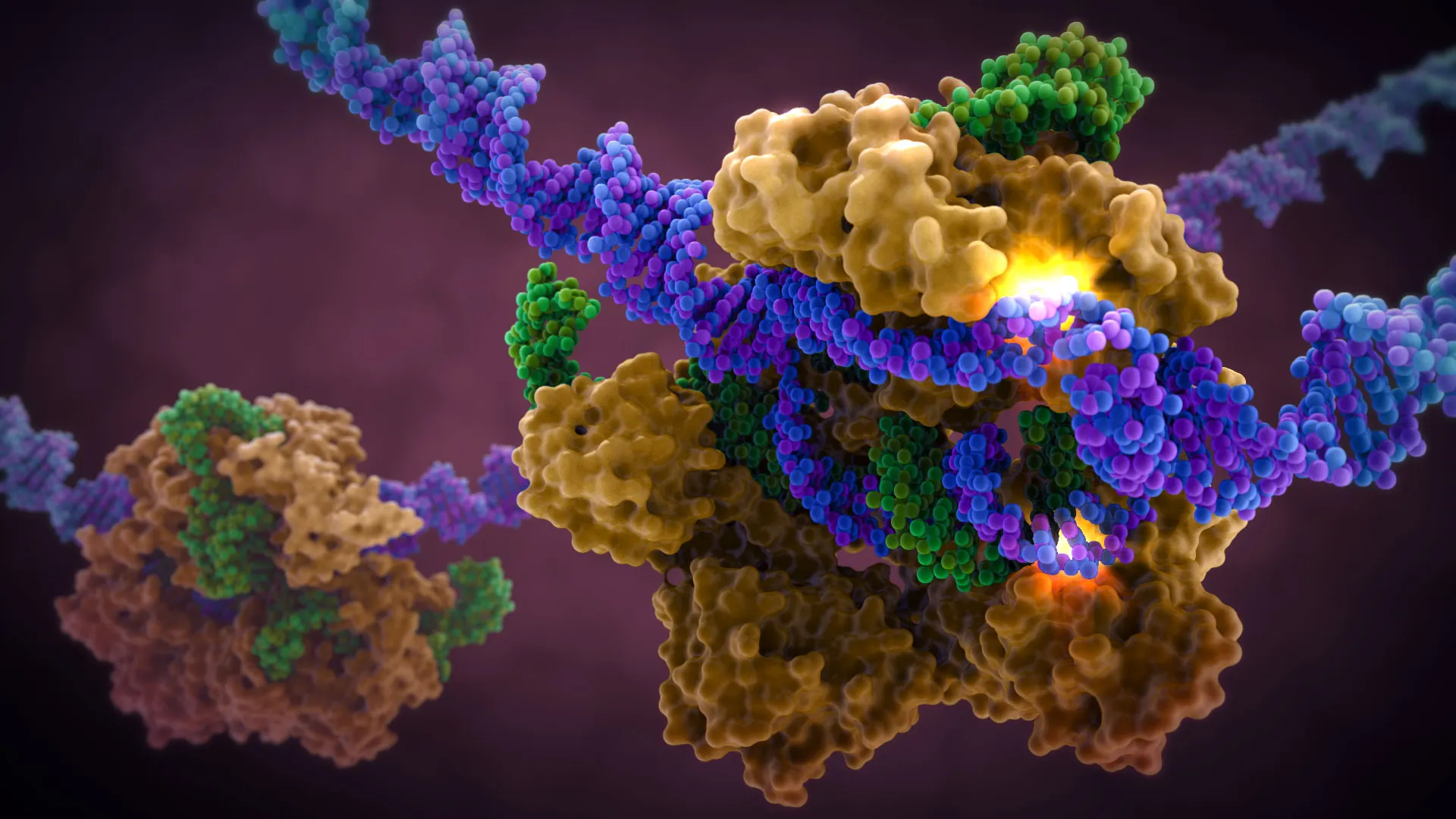
Исследователи показали, что AriA и AriB собраны в супрамолекулярный иммунный комплекс и выяснили его структуру с помощью криоэлектронной микроскопии. Сенсор AriA собран в каркас в форме пропеллера, который координирует работу трех субъединиц AriB и удерживает токсин в неактивном состоянии. Когда в клетке появляется триггер, то есть белок-активатор, например Ocr, сенсор AriA связывается непосредственно с ним, что приводит к высвобождению активного димера эффектора токсина AriB. Авторы показали, что AriB - это РНКаза, которая расщепляет лизин тРНК в клетке, что приводит к ингибированию трансляции и гибели клетки.
«Гонка вооружений» в случае с PARIS наблюдается в чистом виде: иммунная система бактерий вызывает появление антииммунных белков у вирусов. В ответ на это в бактериях начинает действовать система PARIS. Некоторые фаги пошли еще дальше: бактериофаг Т5 научился подавлять защитную систему PARIS. «Как в детективной истории, неожиданно выяснилось, что фаг Т5 в Москве и в Париже - это немного разные фаги: московский фаг потерял фрагмент генома и несколько генов тРНК, что сделало его чувствительным к защите PARIS. Мы показали, что вирусная лизиновая тРНК необходима фагу для успешного заражения PARIS-клеток, поскольку она не расщепляется белком AriB, и таким образом фаг Т5 спасает клетку от токсического воздействия системы PARIS, только для того, чтобы произвести собственное потомство», - комментирует одна из первых соавторов работы, Светлана Белухина, аспирант программы Сколтеха Life Sciences.
«Такая последовательная эволюционная борьба, появление новых способов защиты и антизащиты, иммунитета и его подавления, все еще позволяет микробным популяциям, бактериям и фагам сосуществовать и продолжать эволюционировать вместе. Это отличный пример того, что эволюцию невозможно остановить. Кроме того, наша работа дала новый ответ на давно известную загадку: зачем вирусы в принципе кодируют свои собственные тРНК? Оказывается, в некоторых случаях молекулы тРНК помогают вирусу справиться с бактериальной иммунной системой. Предположительно, тРНК могут играть аналогичную роль у некоторых вирусов, заражающих человека», - добавил еще один соавтор исследования Михаил Скутель.
Авторы подчеркнули, что их работа стала возможной благодаря открытому обмену данными и равному вкладу нескольких лабораторий. «Современная биология невозможна без сотрудничества и междисциплинарной экспертизы. В нашем исследовании нам потребовалось использовать методы структурной биологии, биоинформатики, микробиологии и работать с радиоактивными метками, что зачастую невозможно совместить в рамках одной лаборатории. Без международного сотрудничества и высокого уровня конкуренции, которые значительно стимулировали нашу работу, подготовка этой публикации вряд ли была бы возможна», - отметил Исаев.