Pseudomonas aeruginosa - это условно-патогенная бактерия, присутствующая во многих экологических нишах, таких как корни растений, застойная вода или даже печные трубы.
Будучи очень широко распространенной, она может вызывать острые и хронические инфекции, которые потенциально смертельны для людей с ослабленной иммунной системой. Присутствие P. aeruginosa в клинических условиях, где она может колонизировать например катетеры, представляет собой серьезную угрозу. Кроме того, адаптивность и резистентность ко многим антибиотикам делают инфекции, вызванные P. aeruginosa, все более трудноизлечимыми. Поэтому существует острая необходимость в разработке новых антибактериальных препаратов.
Ученые из Женевского университета (UNIGE), Швейцария, выявили ранее неизвестный регулятор экспрессии генов в этой бактерии, отсутствие которого значительно снижает патогенность P. aeruginosa. Эти результаты, опубликованные в журнале Nucleic Acid Research, могут стать инновационной мишенью в борьбе с этим патогеном.
РНК-хеликазы выполняют важнейшие регуляторные функции, сворачивая и разворачивая различные молекулы РНК для выполнения своих функций. РНК-хеликазы присутствуют в геномах почти всех известных живых организмов, включая бактерии, дрожжи, растения и человека; однако они приобретают специфические свойства в зависимости от организма, в котором обнаружены. "У Pseudomonas aeruginosa есть РНК-хеликаза, функция которой была неизвестна, но которая была обнаружена и у других патогенов", - объясняет соавтор работы Мартина Валентини. "Мы хотели понять, какова ее роль, в частности, в отношении патогенеза бактерий и их адаптации к окружающей среде".
Для этого исследователи объединили биохимический и молекулярно-генетический подходы. "В отсутствие этой РНК-хеликазы P. aeruginosa нормально размножается in vitro, как в жидкой среде, так и на полутвердой среде при 37°C", - сообщает Стефан Хаусманн, первый автор данного исследования. "Чтобы определить, влияет ли это на инфекционную способность бактерий, мы должны были наблюдать это in vivo в живом организме".
Ученые продолжили свои исследования, используя личинки Galleria mellonella, модельного насекомого для изучения взаимодействия хозяина и патогена. Иммунная система насекомых имеет большое сходство с иммунной системой млекопитающих. Кроме того, эти личинки могут жить при температуре от 5°C до 45°C, что позволяет изучать рост бактерий при различных температурах, в том числе и при температуре человеческого тела. Наблюдали три группы личинок; в первой, после инъекции физиологического раствора, выжило 100% популяции. В присутствии обычного штамма P. aeruginosa через 20 часов после заражения выжило менее 20%. Напротив, когда P. aeruginosa была лишена гена РНК-хеликазы, более 90% личинок остались живы. "Модифицированные бактерии стали практически безвредными, оставаясь при этом очень живыми", - говорит Хаусманн.
Результаты работы показывают, что этот регулятор влияет на производство нескольких факторов вирулентности бактерий. "Фактически, этот белок контролирует деградацию многочисленных мессенджерных РНК, кодирующих факторы вирулентности", - резюмирует Мартина Валентини.
"С точки зрения стратегии применения противомикробных препаратов, отключение факторов вирулентности патогена вместо того, чтобы пытаться полностью его уничтожить, означает позволить иммунной системе хозяина естественным образом нейтрализовать бактерию и потенциально снизить риск развития резистентности. Действительно, если мы пытаемся уничтожить бактерию любой ценой, бактерии приспосабливаются к выживанию, что благоприятствует появлению резистентных штаммов".
В настоящее время исследователи проводят скрининг ряда известных лекарственных молекул, чтобы определить, обладает ли какая-либо из них способностью избирательно блокировать этот белок, и детально изучить механизмы ингибирования, на которых может быть основана разработка эффективной терапевтической стратегии.
Stéphane Hausmann et al. РНК-геликаза DEAD-box RhlE2 является глобальным регулятором образа жизни и патогенеза Pseudomonas aeruginosa (аннотация).
РНК-хеликазы выполняют важные регуляторные функции во всех сферах жизни, связывая и разворачивая молекулы РНК. Бактериальные RhlE-подобные DEAD-box РНК-хеликазы являются одними из наименее хорошо изученных среди этих ферментов. Они широко распространены, особенно среди протеобактерий, геномы которых часто кодируют множество гомологов. Значение экспансии и диверсификации RhlE-подобных белков для жизнеспособности бактерий еще не выяснено. В данном исследовании мы изучаем два гомолога RhlE, присутствующие у условно-патогенного микроорганизма Pseudomonas aeruginosa.
Мы показали, что в ходе эволюции RhlE1 и RhlE2 разошлись в своих биологических функциях, молекулярных партнерах и РНК-зависимых ферментативных активностях. В то время как RhlE1 в основном необходим для роста в холоде, RhlE2 действует как глобальный посттранскрипционный регулятор, влияя на уровень сотен клеточных транскриптов, необходимых как для адаптации к окружающей среде, так и для вирулентности.
Глобальное влияние RhlE2 опосредовано его уникальным С-концевым расширением, которое поддерживает активность N-концевого домена по разворачиванию РНК, а также РНК-зависимое взаимодействие с эндонуклеазой RNase E и клеточным механизмом деградации РНК. В целом, наша работа показывает, как функциональное и молекулярное расхождение между двумя гомологичными РНК-хеликазами может способствовать бактериальному функционированию и патогенезу.
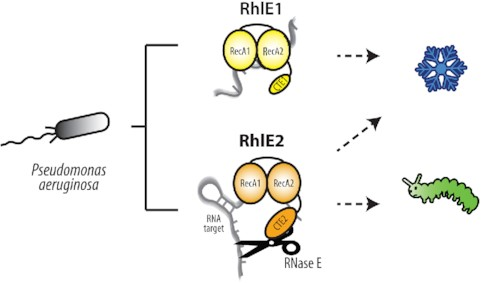
Схематическое изображение биологической роли RhlE1 и RhlE2 у Pseudomonas aeruginosa.