Ученые ФИЦ Биотехнологии РАН составили всесторонний обзор свойств дрожжевых прионов — особых белковых структур, способных стабильно размножаться и наследоваться в ряду поколений дрожжей.
Прионы этих микроскопических грибов широко используются как модель для изучения нейродегенеративных заболеваний, поскольку в организме человека подобные структуры приводят к развитию заболеваний, таких как, например, болезни Альцгеймера и Паркинсона. Знание свойств прионов поможет разработать лекарства от нейродегенеративных заболеваний и замедлить их развитие у пожилых людей. Результаты исследования, проведенного при поддержке национального проекта «Наука и университеты», опубликованы в International Journal of Molecular Sciences.
Иногда белки человека и животных теряют свою нормальную укладку и образуют специфические нитевидные агрегаты или фибриллы, называемые амилоидами. Эти структуры способны запускать «цепную реакцию», присоединяя к себе все новые и новые молекулы нормальной формы того же белка, изменяя его укладку на себе подобную. Это позволяет амилоидам расти, размножаться и распространяться в пределах организма, вызывая неизлечимые заболевания — амилоидозы, среди которых у человека наиболее распространены болезни Альцгеймера и Паркинсона. На сегодняшний день от них страдают десятки миллионов людей во всем мире, и это число быстро растет по мере старения человечества, что представляет существенный вызов для мирового здравоохранения. Кроме того, некоторые амилоиды способны даже заражать других людей или животных, поэтому им дали собственное название — прионы, или инфекционные белки. С прионами связывают группу сравнительно редких, хотя и достаточно известных заболеваний, таких как болезнь Крейцфельдта-Якоба, куру, коровье бешенство и скрейпи овец.
Однако не для всех живых организмов прионы вредны. Так, у дрожжей — одноклеточных микроскопических грибов — прионы не несут значительного вреда клетке, а иногда даже могут быть полезны, увеличивая ее устойчивость к неблагоприятным условиям окружающей среды. Изучение прионов и амилоидов на животных моделях — длительный, трудоемкий и даже опасный процесс, из-за чего он требует высокого уровня лабораторной защиты. Прионы дрожжей не имеют этих недостатков, и потому являются удобной моделью для ученых. Данные, полученные с их помощью, можно использовать для разработки лекарств от нейродегенеративных заболеваний.
Ученые из ФИЦ Биотехнологии РАН (Москва) проанализировали множество работ, изучающих свойства прионов дрожжей, и обобщили их результаты в виде обзора. В нем авторы постарались дать максимально полную картину молекулярного устройства данных белков и механизмов их взаимодействия с клеткой.
Так, в статье подробно описан наиболее изученный прион дрожжей — Sup35, который участвует в контроле синтеза белков. Если в геноме микроорганизма случайно возникает мутация, преждевременно завершающая синтез белка, прион Sup35 позволяет преодолеть это нарушение. Например, дрожжи с мутацией гена ade1-14 не способны синтезировать аденин из-за того, что этот процесс прерывается в определенном месте, соответствующем мутации в гене. Это приводит к накоплению промежуточного продукта — пигмента, который придает красный цвет колониям дрожжей. Однако, если в клетке есть прион Sup35, он помогает «преодолеть» мутацию ade1-14 и довести синтез аденина до конца. В результате окрашенный продукт не накапливается и цвет колоний меняется на белый или различные оттенки розового, в зависимости от «силы» приона.
В обзоре авторы наглядно представляют структуру приона Sup35 и белков, взаимодействующих с ним. Вероятно, впервые такой рисунок удалось представить с соблюдением всех молекулярных пропорций. Он позволил исследователям продемонстрировать уникальную особенность амилоидов: очень плотную упаковку белковых молекул в амилоидной фибрилле. Так, одна белковая молекула в составе амилоида занимает в 11 раз меньшее пространство по длине фибриллы, чем молекула актина в пучке мышечных волокон. В связи с этим, на рисунке удалось разместить лишь малую долю от количества молекул, взаимодействующих с прионом Sup35. Столь плотная упаковка должна накладывать ограничения на взаимодействие амилоида с другими молекулами, в частности, с белками-шаперонами, которые пытаются «бороться» с прионами, растворяя их.
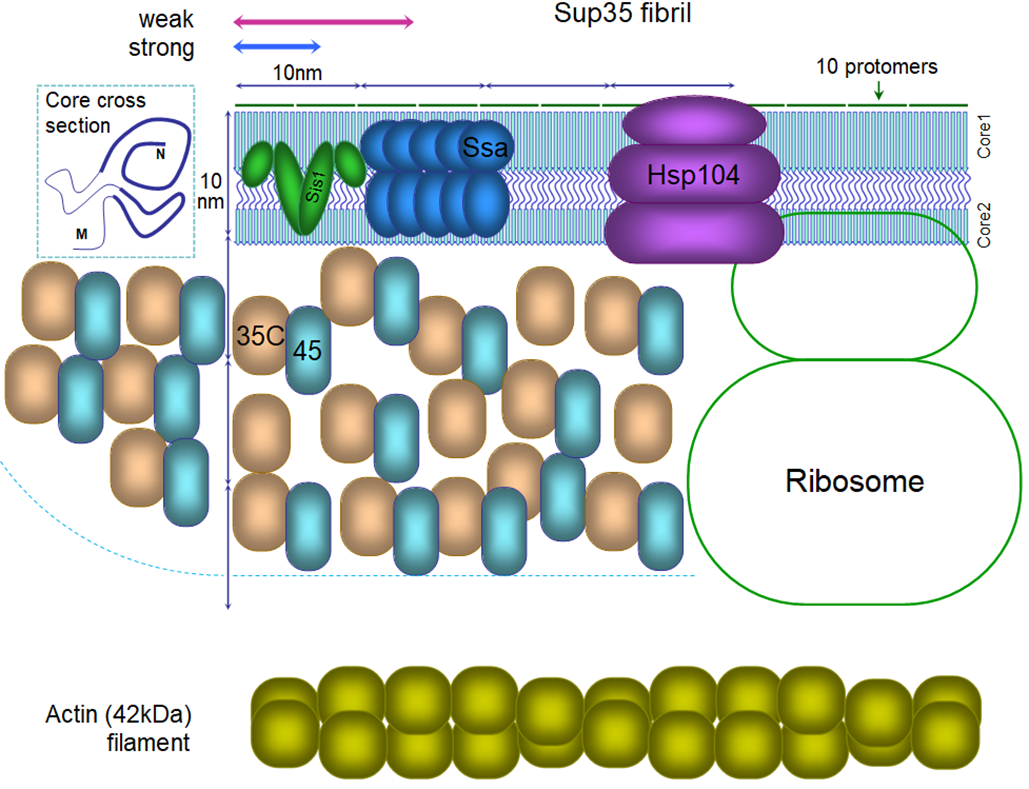
Весьма любопытно, что эта борьба обычно дает противоположный результат, помогая прионам размножаться. Интересное свойство прионов дрожжей, как и всех амилоидов, состоит в том, что, если из этой плотной структуры извлечь всего одну входящую в нее белковую молекулу, что делает шаперон Hsp104, то прион распадется на две части. При этом оба получившихся фрагмента остаются способными «заражать» нормальные белки. Именно так и происходит размножение прионных частиц. Применительно к дрожжам, этот процесс необходим для того, чтобы прионы в равной мере доставались при делении дочерним клеткам. В организме человека разделение прионов и амилоидов на более мелкие и более мобильные фрагменты позволяет им легче распространяться в пределах организма. Также множество данных говорит о том, что они более токсичны.
Прионные белки дрожжей обычно содержат две части. Одна из них, сравнительно небольшая, образует амилоидный стержень приона. Другая — отвечает за функцию белка, и эта функция уменьшается или модифицируется, когда нормальный белок превращается в прион. Многочисленные исследования показали, что, когда эта функциональная область находится в самом начале или в конце белка, ее переход в прионную форму происходит более охотно.
Но авторы обзора обнаружили еще более яркое явление: если из-за мутации синтез белка преждевременно завершается сразу после прионогенной области, помещая ее на конец белка, то частота первичного появления приона возрастает в 6000 раз. Это наблюдение подкрепляет и детализирует одну из популярных гипотез появления амилоидов у человека в результате соматических мутаций. И расчеты показывают, что число клеток с такими мутациями, которые могут быть очагами возникновения амилоидоза, в организме каждого человека исчисляется миллионами.