Уильям А. Хазелтайн - известный ученый-биомедик и педагог, преподавал в Гарвардской медицинской школе и руководил разработкой первых методов лечения ВИЧ/СПИДа.
Он известен своими новаторскими работами в области рака, СПИДа и геномики, а также тем, что ввел в обиход термин «регенеративная медицина». Будучи президентом ACCESS Health International, он стремится воплотить достижения медицины в улучшение здоровья людей по всему миру. Хазелтайн часто выступает с комментариями в крупнейших средствах массовой информации и является активным автором ведущих изданий, включая Forbes, The Washington Post и Scientific American. Ниже приводиться краткое содержание его статьи "The RNA Revolution in the Central Molecular Biology Dogma Evolution".
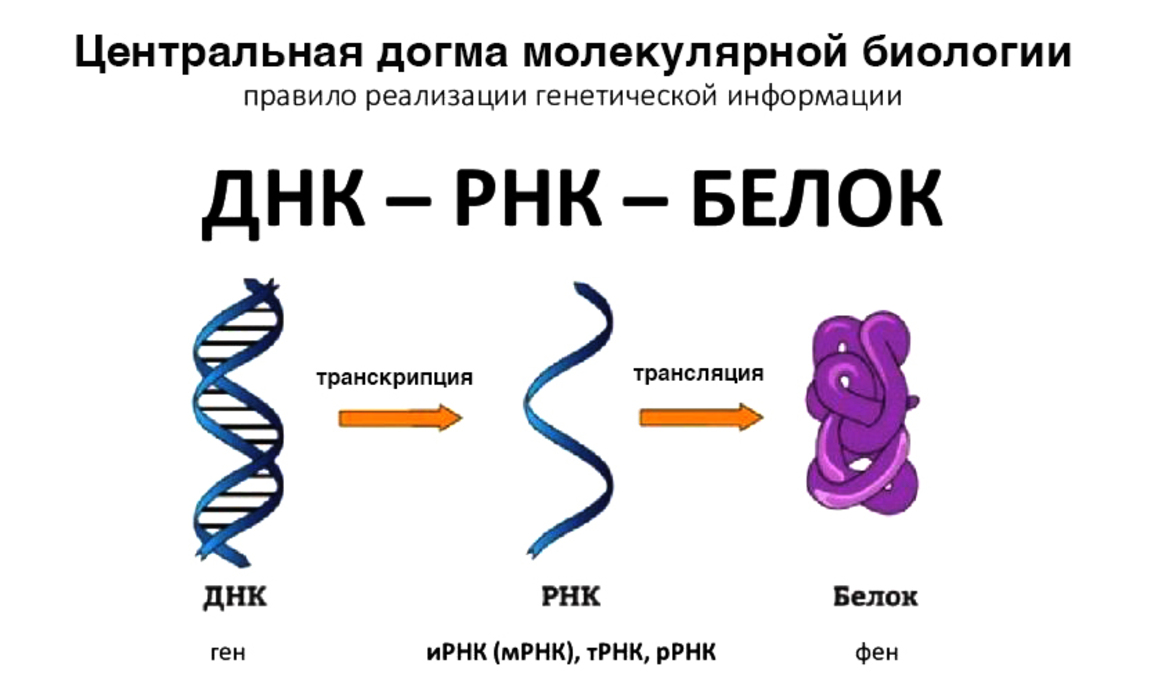
В течение десятилетий центральная догма молекулярной биологии - ДНК создает РНК, РНК создает белок, белок создает фенотип - была руководящей основой для понимания наследственности и заболеваний. Эта модель объясняла классические менделевские признаки, например, как одиночные мутации ДНК в белково-кодирующих областях могут вызывать такие заболевания, как серповидно-клеточная анемия. Однако на это приходится лишь около 2% менделевского наследования и возникающих при этом фенотипических изменений.
Подавляющее большинство мутаций, влияющих на фенотип, - почти все, на самом деле, - обнаруживаются не в белково-кодирующих областях, а в регуляторных областях и среди огромной популяции некодирующих РНК. Эти РНК, многие из которых не кодируют крупные белки, играют важнейшую роль в контроле экспрессии генов и, в конечном счете, фенотипов. Это объясняется двумя причинами. Во-первых, количество РНК просто огромно. Во-вторых, даже некоторые РНК, которые долгое время считались «некодирующими», на самом деле производят сотни тысяч небольших пептидов, а по некоторым оценкам - до 200 000. С точки зрения генетики это означает, что функциональных генов в десять раз больше, чем мы считали ранее.
После того как ученые нашли первые 20 000 генов, кодирующих белки, они продолжали находить все больше РНК - более чем в десять раз больше длинных, стабильных, полиаденилированных, каппированных РНК. Тогда исследователи предположили, что они могут быть значимыми. Теперь мы знаем: многие из них являются функциональными РНК и при мутации они могут вызывать определенные фенотипы. Некоторые из этих длинных некодирующих РНК даже производят небольшие пептиды, и мутации в них также могут вызывать фенотипические изменения.
Мы можем представить себе это в терминах детского конструктора LEGO. Из одного и того же набора деталей LEGO можно построить простую или сложную структуру. Белки - это блоки, представляющие варианты, но инструкции, регуляторные РНК, - это то, что делает разницу. Вот почему у червя и человека может быть примерно одинаковое количество генов, а человек при этом гораздо сложнее. Сложность обусловлена инструкциями, а не только строительными блоками. Некодирующие РНК, включая микроРНК, длинные некодирующие РНК и другие, а также пептиды, которые они кодируют, являются инструкциями. Они определяют, когда, где и в каком количестве будет построен каждый белковый «кирпичик». Для этого они контролируют экспрессию генов на разных уровнях. Эти РНК могут глушить гены, ремоделировать хроматин и направлять химические модификации ДНК и РНК.
С помощью редактирования, метилирования и других модификаций РНК могут изменять свою собственную функцию или функцию своих мишеней, не изменяя при этом основную последовательность ДНК. Мутации в этих РНК или кодируемых ими пептидах могут приводить к специфическим фенотипам и заболеваниям, расширяя число функциональных генов по меньшей мере на порядок. Давайте рассмотрим несколько примеров из реального мира. Во-первых, любая РНК может играть регуляторную роль, а один участок ДНК может производить как белок-кодирующую, так и регуляторную РНК. Например, когда на клетки воздействует ультрафиолет, они переключаются с производства типичной белок-кодирующей РНК на более короткую, некодирующую версию того же гена. Эта новая РНК помогает клетке восстановиться после повреждения ДНК, действуя почти как противовес белку, производимому этим геном.
Еще один интересный момент: некоторые так называемые «некодирующие» РНК на самом деле содержат крошечные инструкции по созданию коротких пептидов - маленьких белковых фрагментов, которые могут оказывать большое влияние. Эти микропептиды могут влиять на все: от роста и выживания клеток до развития мозга и прогрессирования рака. Некоторые из них даже действуют как гормоны. Другими словами, то, что мы когда-то считали «нежелательной» или «молчащей» РНК, часто оказывается совсем не тем, чем кажется.
Роль РНК как носителя наследственной информации не ограничивается ее посреднической функцией. У некоторых вирусов РНК является основным генетическим материалом. Ретровирусы и ретротранспозоны используют РНК для создания ДНК, тем самым встраивая новые генетические элементы в геном - процесс, который сформировал примерно половину человеческого генома и продолжает влиять на старение и рак.
Расширенная догма теперь признает многонаправленный поток генетической информации. Эта модель отражает не только традиционный поток от ДНК к РНК, но и способность РНК направлять модификации ДНК, регулировать экспрессию генов и даже служить шаблоном для синтеза ДНК в некоторых вирусах и клеточных процессах. Влияние РНК распространяется и за пределы клетки: РНК может передаваться между клетками и даже через границы видов через внеклеточные везикулы, влияя на иммунитет, развитие и заболевания. Новая догма признает, что биологические системы по своей природе избыточны и гибки. Молекулы РНК могут мимикрировать, взаимодействовать друг с другом, что позволяет одному генотипу давать множество фенотипов, а одному фенотипу - возникать из разных генотипов. Эта пластичность лежит в основе эволюции, адаптации и устойчивости к заболеваниям.
Это не просто техническое обновление, это концептуальный скачок. РНК лежит в основе биологической сложности. Практические последствия глубоки. Вакцины и терапия на основе РНК уже меняют медицину. Технологии РНК-интерференции и CRISPR развивают растениеводство и синтетическую биологию. Теперь задача состоит в том, чтобы разработать РНК, которые были бы стабильными, специфичными и безопасно доставлялись в клетки-мишени - задача, требующая глубокого понимания структурного и функционального разнообразия РНК.
Как человек, наблюдавший за развитием молекулярной биологии, я одновременно смирен и воодушевлен этой революцией РНК. Это напоминание о том, что наука не стоит на месте: наши модели условны, наши догмы подлежат пересмотру. Геном - это не застывший чертеж, а динамичная и быстро реагирующая система, в центре которой находится РНК. Приняв сложность и многогранность РНК, мы сможем открыть новые методы лечения, глубже понять заболевания и оценить истинное богатство молекулярного механизма жизни.