У людей, заразившихся сальмонеллой, наблюдаются симптомы различной степени тяжести - многие страдают диареей и лихорадкой, в то время как у некоторых симптомы вообще отсутствуют.
Что же определяет исход заболевания при сальмонеллезе? Здесь может действовать множество факторов, например, различия в штаммах сальмонелл, вызывающих инфекции, или вариации в генетическом строении или иммунных реакциях людей. Другими словами, не все клетки (хозяина или патогена) одинаковы или имеют схожую физиологию. Эти факторы могут привести к широкому клиническому спектру инфекций Salmonella.
Сейчас ученые пытаются выявить эту неоднородность во взаимодействии хозяина и сальмонеллы, исследуя поведение отдельных клеток с беспрецедентным разрешением. "Это очень сложное исследование, поскольку количество бактерий на разных стадиях сальмонеллезной инфекции меняется поминутно. Поэтому нам нужны чувствительные инструменты для их исследования", - рассказывает профессор Рой Авраам, главный научный сотрудник отделения иммунологии и регенеративной биологии Института науки Вейцмана, во время сессии ASM Microbe 2022. Одним из методов, который достаточно чувствителен для изучения этих сложных взаимодействий, является секвенирование РНК (RNA-seq). Традиционное РНК-секвенирование позволяет определить средний транскриптом - уровень экспрессии различных генов в клетках - путем количественного определения мессенджерной РНК, или мРНК, в данном образце.
В последнее десятилетие ученые раскрыли потенциал секвенирования РНК единичных клеток (scRNA-seq) для изучения взаимодействия хозяина и микроорганизмов. scRNA-seq предоставляет информацию о транскриптоме в единичных клетках, обеспечивая высокую пространственно-временную картину инфекционного ландшафта. Аналогия, которая часто упоминается в связи с одноклеточными методами, - это фруктовый коктейль: в то время как общие измерения могут дать информацию об основных характеристиках фруктового коктейля, одноклеточные технологии дают информацию об отдельных кусочках клубники, банана, яблока и так далее. Понимание того, какие гены повышены или понижены в отдельных клетках, позволяет понять, почему различные клетки ведут себя так, как они ведут себя. Разработка целенаправленной антимикробной терапии для лечения инфекций Salmonella с различными клиническими исходами остается главной целью такого углубленного понимания.
Когда патоген инфицирует клетку хозяина, патоген активирует программу вирулентности, чтобы вызвать инфекцию, в то время как хозяин активирует защитный иммунный ответ для борьбы с захватчиком. На ход этого перетягивания каната может повлиять множество факторов. Например, когда и где патоген запускает свою программу вирулентности, или какие гены включаются или выключаются в инфицированных клетках в определенное время во время инфекции?
Salmonella enterica серовар Typhimurium (S. Typhi) вторгается в клетки кишечника хозяина и начинает свой внутриклеточный жизненный цикл внутри фагоцитов, таких как макрофаги. При этом бактерия ускользает от иммунного ответа хозяина и впоследствии распространяется по всему организму через кровоток. Известно, что S. Typhi имеет неоднородную скорость репликации как в макрофагах, так и в тканях. Одна субпопуляция S. Typhi быстро растет и вырабатывает белки, которые взламывают клеточные механизмы хозяина, способствуя выживанию патогена. Эти белки вирулентности называются эффекторами и производятся двумя системами секреции III типа (T3SS), которые расположены на островах патогенности Salmonella Pathogenicity Island (SPI) 1 и 2. Между тем, вторая субпопуляция S. Typhi остается в виде нереплицирующихся клеток, называемых персистерами. Персистеры могут проявлять дальнейшую гетерогенность в зависимости от их метаболической активности. Они также резистенты ко многим антибиотикам и, следовательно, могут служить резервуаром для хронических инфекций. S. Typhi также проявляет гетерогенность во время инфекции в ответ на изменения иммунного ответа хозяина, что потенциально может перепрограммировать клеточный механизм хозяина на отдельные субпопуляции.
"Патоген сам влияет на иммунитет хозяина и находится под влиянием иммунитета. Ему приходится балансировать между своей репликацией, вирулентной активностью и манипуляцией иммунитетом хозяина", - объясняет Авраам.
scRNA-seq макрофагов, инфицированных S. Typhi, показал, что активно делящиеся сальмонеллы находятся преимущественно в M2-подобных макрофагах, которые являются противовоспалительными и поддерживают рост бактерий. С другой стороны, нереплицирующиеся сальмонеллы находятся преимущественно в М1-подобных макрофагах, которые являются провоспалительными и останавливают рост бактерий. Персистирующие нереплицирующиеся сальмонеллы составляют меньшую субпопуляцию по сравнению с их быстрорастущими собратьями, но они имеют клиническое значение, поскольку резистентны к противомикробным препаратам.
При отмене антибиотиков персистеры могут вызвать рецидив заболевания. Причина этого в том, что, хотя они не растут и не делятся, они все еще метаболически активны и способны перепрограммировать макрофаги через эффекторы вирулентности SPI-2. Это говорит о том, что вариации экспрессии генов в макрофагах хозяина могут создавать различные клеточные среды, которые могут влиять на патоген по-разному - либо позволяя сальмонеллам избегать иммунитета хозяина и выживать скрытно, либо позволяя им избегать антимикробной защиты хозяина и расти.
Большинство исследований до сих пор использовали scRNA-seq для профилирования либо хозяина, либо патогена, но сейчас исследователи работают над одновременной оценкой клеток хозяина и патогена в рамках подхода, называемого двойным RNA-seq. Применение обширного двойного РНК-секвенирования в клетках хозяина, инфицированных Salmonella, показало, что бактериальная малая РНК под названием PinT манипулирует экспрессией многих генов хозяина и бактерий. PinT повышает уровень генов, вовлеченных в воспалительную сигнализацию в кишечнике хозяина - реакцию, от которой зависит, будет ли сальмонелла конкурировать с микробами кишечника и не погибнет ли она от воздействия хозяина. С бактериальной стороны PinT снижает экспрессию определенных эффекторов вирулентности SPI-1 и SPI-2, которые позволяют бактериям размножаться внутриклеточно.
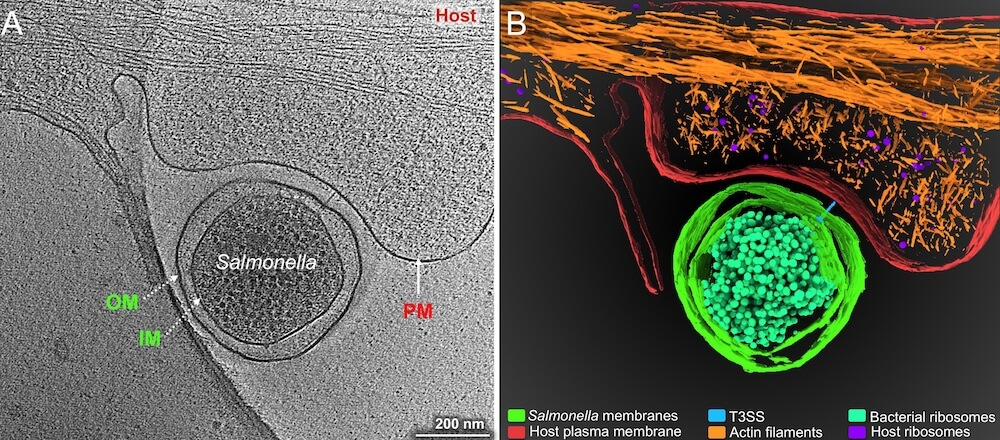
Слева - криоэлектронное изображение S. Typhi, взаимодействующей с мембраной клетки хозяина. Справа - сегментация изображения слева с аннотацией различных клеточных компонентов.
В настоящее время исследователи создают одноклеточную версию двойного секвенирования РНК (scDual-seq) для изучения взаимодействия хозяина и сальмонеллы. На конференции ASM Microbe 2022 Авраам представил разработанную в его лаборатории методику под названием scPAIR-seq для анализа патоген-специфических иммунных реакций в контексте инфекции S. Typhi. Этот метод позволяет исследователям изучать воздействие нескольких бактериальных мутантов на клетки хозяина одновременно и с разрешением в одну клетку.
В данной работе исследователи инфицировали макрофаги библиотекой уникальных штрих-кодов бактерий, имеющих мутации в эффекторах вирулентности SPI-2, чтобы изучить специфические для мутантов изменения транскриптома хозяина. Они обнаружили, что среди эффекторов вирулентности SifA оказывает наиболее значительное влияние на транскриптомы хозяина. SifA помогает сальмонеллам создать защитную нишу внутри вакуолей в макрофагах. В отсутствие SifA S. Typhi присутствует в цитоплазме вместо вакуолей и перепрограммирует инфицированные макрофаги в противовоспалительное состояние М2. Это позволяет бактериям размножаться в цитозоле, что позволяет предположить альтернативный путь заражения. Экспериментальная и компьютерная схема, разработанная в данном исследовании, может быть использована для изучения влияния нескольких эффекторов одновременно у других патогенных бактерий, а также для обеспечения глобального и целостного представления о влиянии эффекторов на иммунные процессы хозяина.
RNA-seq, и в частности scRNA-seq, становится все более популярным выбором для анализа изменений в экспрессии генов во время взаимодействия хозяина и патогена. Эти методы позволили по-новому взглянуть на инфекции S. Typhi и получить представление о гетерогенности как клеток хозяина, так и бактерий. Такие исследования могут раскрыть молекулярные детали того, как иммунные клетки уничтожают патогены, и пространственно-временную эффективность различных противомикробных терапий.
В настоящее время ведется работа по созданию клеточных атласов в различных модельных организмах для выявления различных типов и состояний клеток. Проект "Иммунологический геном" - один из таких проектов, в рамках которого создаются профили экспрессии генов для всех типов иммунных клеток мыши, и он должен сыграть ключевую роль в понимании взаимодействия хозяина и патогена. Этот атлас может быть использован для понимания того, какие гены модулируются в различных типах иммунных клеток во время бактериальных инфекций. Используя такие ресурсы, можно начать отвечать на вопросы почему бактерии инфицируют или размножаются в одних клетках, а не в других, какие иммунные клетки хозяина более восприимчивы к инфекции и почему.
Ученые также предпринимают попытки перенести результаты РНК-секвенирования из лаборатории в клинику. В одной из таких попыток исследователи применили алгоритм, основанный на данных scRNA-seq, для прогнозирования исхода инфекции Salmonella у здоровых людей ex vivo по образцам их крови. Люди с различными типами иммунных клеток - либо с диким типом, либо с полиморфизмом в гене TLR10, который регулирует цитокиновый ответ, - демонстрируют различные фенотипы инфекции. Будущая работа по формированию когорт и прогнозированию клинических исходов инфекционных заболеваний путем анализа гетерогенности на клеточном уровне может помочь в разработке персонализированной терапии для отдельных пациентов.