Грипп может быть тяжелым заболеванием, но когда к нему присоединяется Streptococcus pneumonia, он может стать смертельно опасным.
Исследователи нашли еще одну причину опасности этой двойной инфекции, выявив новый механизм вирулентности поверхностного белка S. pneumoniae. Это открытие произошло более чем через три десятилетия после обнаружения поверхностного белка А (PspA).
Ранее этот механизм не был изучен, поскольку он способствует адгезии бактерий только к мертвым или умирающим эпителиальным клеткам легких, но не к живым клеткам. До этого исследователи обычно использовали монослои здоровых клеток легких для поиска бактериальных адгезинов, способствующих инфекции. Было обнаружено, что уничтожение вирусом клеток легких при гриппе создает условия для прикрепления S. pneumonia к клеткам дыхательных путей, тем самым усугубляя пневмонию.
Исследователи, опубликовавшие статью в журнале Cell Reports, утверждают, что их результаты дают дополнительное объяснение тому, как инфекция вируса гриппа А с последующей суперинфекцией S. pneumoniae вызывает тяжелую пневмонию и высокий уровень летальности. Обнаруженный механизм также указывает на возможные улучшения в терапии заболевания и вакцинации.
Исторический пример смертельного синергизма гриппозной инфекции с последующей суперинфекцией S. pneumoniae можно найти в хранящихся образцах легких после пандемии испанского гриппа 1918 года, в результате которой погибло от 40 до 50 миллионов человек - в подавляющем большинстве этих образцов была обнаружена коинфекция или вторичная инфекция S. pneumonia.
Исследования PspA начались с результатов экспериментального инфицирования легких мышей гриппом А, за которым следовали либо инфицирование S. pneumonia дикого типа, имеющей неповрежденный ген PspA, либо мутантом S. pneumoniae, лишенным PspA. В гомогенатах легких мышей, инфицированных диким типом, количество S. pneumonia было намного выше, чем в легких, инфицированных мутантом. Однако, когда исследователи промыли внутреннюю поверхность легких и собрали бронхоальвеолярный лаваж, они насчитали одинаковое количество S. pneumonia дикого типа и мутанта. "Этот неожиданный результат был интерпретирован как то, что S. pneumoniae дикого типа более устойчивы к вытеснению, чем S. pneumonia с делецией гена pspA, и послужил обоснованием для дальнейших экспериментов", - рассказывает соавтор исследования Карлос Орихуэла.
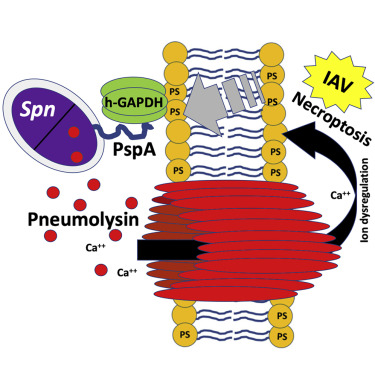
На основании этой находки исследователи смогли показать, что PspA функционирует как адгезин к умирающим клеткам хозяина, в дополнение к нескольким другим ранее установленным механизмам вирулентности. Исследователи также подробно описали молекулярный механизм этой бактериальной адгезии.
Как инфекция гриппа А, так и выделение токсина пневмолизина S. pneumoniae вызывают гибель эпителиальных клеток легких. При гибели клетки остатки фосфатидилсерина переходят на внешнюю клеточную мембрану, где связываются с ферментом хозяина - глицеральдегид-3-фосфатдегидрогеназой, или GAPDH. В свою очередь, PspA S. pneumoniae на поверхности бактерии связывается с GAPDH. PspA-GAPDH-опосредованное связывание с клетками легких увеличивало локализацию S. pneumoniae в нижних дыхательных путях, и это усиливалось при воздействии пневмолизина или ко-инфекции вирусом гриппа А. Исследования фрагментов белка PspA показали, что 52-аминокислотная часть белка - с аминокислоты 230 по 281 - необходима для связывания GAPDH. Введение одного из этих фрагментов в легкие инфицированных гриппом мышей уменьшило тяжесть заболевания при суперинфекции S. pneumoniae, предположительно за счет конкурентного связывания.
"Наши результаты подтверждают возможность использования участков PspA для разработки терапевтических средств и вакцин против суперинфекций гриппа А/Streptococcus pneumoniae", - отметил Орихуэла. "Важно отметить, что, несмотря на более чем 30-летнюю историю открытия PspA, ранее не было показано, что PspA функционирует как адгезин.
Таким образом, обнаруженная нами роль PspA в адгезии существенно расширяет наши знания о взаимодействии S. pneumoniae с хозяином".