Патогенные бактерии у человека развивают резистентность к антибиотикам намного быстрее, чем ожидалось.
Исследования, проведенные в Технологическом университете Чалмерса (Швеция), показывают, что одной из причин может быть значительный генетический перенос между бактериями экосистем и человеком. Эта работа, опубликованная в MicrobiologyOpen также привела к появлению новых инструментов для исследователей резистентности.
Совершенно разные виды бактерий могут распространять гены резистентности друг другу через плазмиды - небольшие молекулы ДНК, где бактерии хранят некоторые из своих генов вне хромосом. При контакте двух бактериальных клеток они могут передавать плазмиды друг другу. Это называется конъюгацией, и это самый важный механизм распространения антибиотикорезистентности.
"В последние годы мы видели, что гены резистентности распространялись в патогенных микроорганизмах человека в гораздо большей степени, чем кто-либо ожидал", - говорит Ян Зримец, один из авторов статьи.
"Многие из генов, по-видимому попали в широкий спектр видов бактерий из окружающей среды (почва, вода) и растительных бактерий. Это было трудно объяснить, потому что, хотя конъюгация очень распространена, считалось, что существуют определенные условия, при котором виды бактерий могут переносить плазмиды друг к другу".
Плазмиды принадлежат к различным группам подвижности, или MOB-группам, поэтому они не могут переноситься между любыми видами бактерий. Зримец разработал новые методы анализа данных, которые показывают, что генетический перенос может быть гораздо более неограниченным и распространенным, чем ожидалось ранее.
Среди прочего, он разработал алгоритм, способный идентифицировать конкретные участки ДНК, необходимые для конъюгации - так называемые оriT-области - в больших объемах данных, состоящих из генетических последовательностей ДНК тысяч плазмид. Алгоритм также может сортировать плазмиды по MOB-группам на основе идентифицированных областей оriT. Он использовал этот алгоритм для изучения известных последовательностей генов более чем 4600 плазмид естественного происхождения от различных типов бактерий, что ранее не представлялось возможным сделать систематически.
Результаты показывают, среди прочего, что:
- Количество областей оriT может быть почти в восемь раз больше, чем найдено с помощью стандартных методов, используемых сегодня.
- Количество мобильных плазмид может быть в два раза больше, чем было известно ранее.
- Количество видов бактерий, имеющих мобильные плазмиды, может быть почти в два раза больше, чем было известно ранее.
- Более половины этих плазмид имеют области оriT, которые соответствуют ферменту конъюгации из другой плазмиды, которая ранее была классифицирована в другой группе MOB. Это означает, что они могут переноситься одной из этих плазмид, в одной и той же бактериальной клетке.
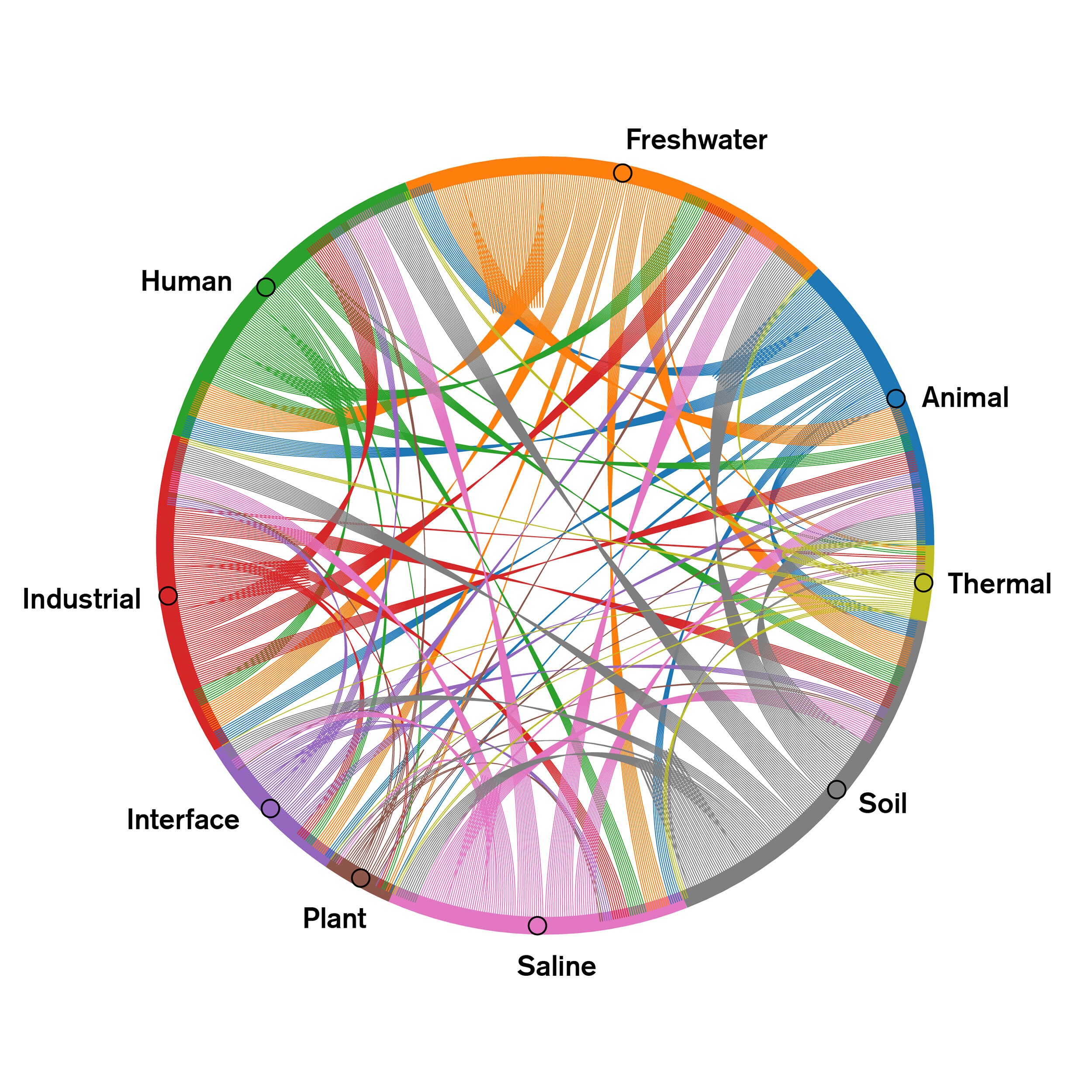
Последнее означает, что могут существовать механизмы переноса между большим количеством видов бактерий и средой, в которой, как мы ранее считали, существовали барьеры.
"Эти результаты могут означать, что существует надежная сеть для переноса плазмид между бактериями человека, животных, растений, почвы, водной среды и индустрии", - объясняет Зримец.
"Гены резистентности естественным образом встречаются у многих различных бактерий в этих экосистемах и эта гипотетическая сеть может означать, что гены из всех этих сред могут быть переданы бактериям, вызывающим заболевания у человека. Это может быть возможной причиной быстрого развития резистентности патогенных микроорганизмов человека, которое мы наблюдали в последние годы. Наше широкое применение антибиотиков позволяет выбирать гены резистентности, которые могут поступать из гораздо большего, чем мы предполагали ранее, естественного генетического резервуара".
Результаты должны быть проверены экспериментально в будущем, но разработанные исследователями методы анализа данных уже могут быть использованы многими исследователями, работающими с антибиотикорезистентностью в различных областях медицины и биологии. Они представляют собой новый мощный инструмент для систематического картирования потенциальной переносимости различных плазмид.
"Я надеюсь, что эти методы смогут принести пользу большой части исследований в области антибиотикорезистентности, которая является чрезвычайно междисциплинарной областью Эти методы могут быть использованы в исследованиях, направленных на разработку более эффективных ограничений на использование антибиотиков, инструкций по применению антибиотиков и новых типов веществ, которые могут предотвратить распространение генов резистентности на молекулярном уровне", - говорит Зримец.
Подробнее о генетическом перенос путем конъюгации и о новом методе в сравнении с существующим стандартом
Для начала конъюгации необходим фермент - релаксаза, который располагается в определенном месте на плазмиде. Релаксаза должна распознавать и связываться с областью, в которой можно разрезать кольцо ДНК и перенести нить в следующую бактерию. Эта область ДНК называется местом происхождения переноса, или oriT.
Ранее считалось, что отдельная плазмида должна содержать как ген релаксазы, так и подходящий oriT, чтобы быть переданной другим бактериям. Но бактериальная клетка может содержать несколько плазмид и в последние годы различные исследователи показали, что релаксаза из одной плазмиды может соответствовать области oriT на другой плазмиде в той же самой клетке и активировать конъюгацию этой плазмиды.
Это означает, что для плазмиды может быть достаточно иметь только oriT, чтобы иметь возможность конъюгировать, что, в свою очередь, означает, что многие плазмиды, которые ранее классифицировались как немобильные, потому что у них нет гена релаксазы, могут конъюгировать. Но до сих пор неизвестно, насколько распространено это явление среди бактерий. Это один из пробелов в знаниях, которые результаты Зримеца помогают заполнить.
Современные стандартные средства оценки переносимости плазмид основаны на поиске последовательностей ДНК для фермента релаксазы или для областей oriT, к которым может подсоединиться фермент. Существует несколько ключевых ограничений для этого. Некоторые методы дают неполные результаты, в то время как другие требуют чрезвычайно трудоемких и ресурсоемких лабораторных исследований.
Новый метод анализа данных Зримеца основан исключительно на идентификации областей oriT, с использованием особых физико-химических свойств, обнаруженных конкретно в областях oriT. В ходе предыдущих исследований Зримец показал, что эти физиохимические признаки, определяющие, какая релаксаза может связываться с oriT, более стабильны и специфичны, чем сами последовательности ДНК. Это позволяет классифицировать плазмиды по нужным группам MOB на основе области oriT, независимо от релаксазы, что также позволяет исследователям картировать общую переносимость между различными видами бактерий и окружающей средой.
Метод может оперировать большими объемами данных и может быть использован для эффективного поиска областей oriT на плазмидах во всей их полноте.