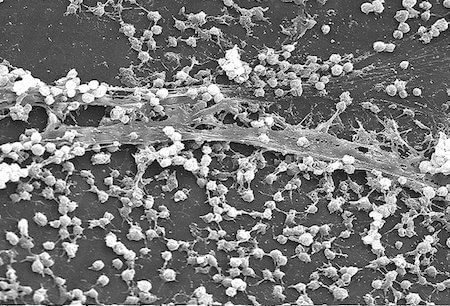
Биопленки представляют собой группу адгезивных неподвижных колоний бактерий, образующих синтрофный консорциум. Многовидовые сообщества биопленок наблюдались как в биотических, так и в абиотических средах обитания, включая человеческое тело.
Известно, что помимо бактерий, развитие биопленок происходит также у грибков и водорослей. Образование биопленки обеспечивает укрытие колоний микроорганизмов от различных видов воздействия окружающей среды и связано с 60-80% патогенных инфекций. Развитие биопленки является важным фактором вирулентности, особенно для тех видов микроорганизмов, которые могут уклоняться от иммунного ответа хозяина. Генетические изменения также играют решающую роль в развитии вирулентности, а также резистентности к антибиотикам. Многофакторная природа биопленок может усиливать устойчивость бактерий к обычным лекарственным препаратам, тем самым создавая проблему в использовании антибиотиков.
Механизм образования биопленок варьирует от вида к виду, но общей чертой являются внеклеточные полимерные вещества (EPS), которые удерживают клетки вместе. Кворум сенсинг (QS) - это способность бактерий определять плотность клеток и синхронизировать свое поведение посредством межклеточной сигнализации с помощью небольших молекул, известных как аутоиндукторы (Ais). Эти Ais заставляют клетки, образующие биопленку, объединяться друг с другом посредством секреции EPS, которые в основном отвечают за проявление вирулентности у патогенов.
Таким образом, современной задачей является понимание того, как QS работает в среде хозяина, что делает исследования чувствительности к антимикробным препаратам сложными, особенно при отсутствии консенсуса или стандартизированных протоколов. Вооружившись базовым пониманием того, как биопленки способствуют QS и защищают микробное сообщество от антибиотиков, многие исследователи изучали различные соединения и вещества с целью подавить образование биопленок или, по крайней мере, нарушить взаимодействие между бактериями для снижения их патогенности. Подборка статей в данном обзоре поможет читателю получить новые знания и исследовательские концепции, относящиеся к роли биопленок в вирулентности заболеваний и развитии устойчивости к антибиотикам.
Sun et al. оценили ингибирующее действие эскулетина (растительного фенольного соединения, известного как гидроксилированный кумарин) на QS и формирование биопленки грамотрицательных бактерий (Aeromonas hydrophila). Результаты исследования показали, что эскулин может подавлять роевую подвижность A. hydrophila и образование биопленок, что было определено с помощью конфокальной лазерной сканирующей микроскопии и сканирующей электронной микроскопии. Это подтверждается также снижением экспрессии генов, связанных с QS и формированием биопленки, по данным количественного RT-PCR.
В другом исследовании Jiang et al. изучили влияние соединения Str7410, ингибитора аутоиндуктора-2 (AI-2), на межвидовые QS in vitro и in vivo. Авторы отметили, что ко-культура Pseudomonas aeruginosa и Streptococcus aureus, обработанная комбинацией Str7410 и антибиотика меропенем тригидрат, может увеличить восприимчивость клеток биопленки к антибиотику, помимо ингибирования AI-2 сигнализации и снижения экспрессии генов, связанных с QS, у P. aeruginosa.
Еще одно исследование, посвященное QS, было проведено Beenker et al. Целью этого исследования было изучение влияния вторичных метаболитов грибов на ингибирование QS. Они сообщили, что соединения семейства грегатинов могут ингибировать QS у P. aeruginosa, но не образование биопленки.
Jarzynka et al. провели интересное исследование влияния олигосахаридов человеческого молока (ОЧМ) на активность по уничтожению биопленок. Многие предыдущие исследования использовали стрептококки в качестве модели для оценки антимикробной активности ОЧМ. Однако в данном исследовании антимикробная активность ОЧМ изучалась с использованием широкого спектра бактерий, включающего семь грамположительных и грамотрицательных видов. Результаты исследования показали, что антимикробная активность ОЧМ была в основном эффективна в отношении грамположительных видов. Им также удалось идентифицировать фукозиллактозу как антибактериальный компонент в составе ОЧМ.
Наконец, в статье Flores-Vargas et al. описывается, как естественные речные биопленки могут служить резервуаром резистентности к антибиотикам. Несмотря на то, что угроза резистентности к противомикробным препаратам выше в таких горячих точках, как больницы и фермы, авторы предупреждают, что окружающая среда такая как озера и реки, также постоянно подвергается воздействию субингибиторных уровней антибиотиков, что оказывает давление на селекцию резистентных бактерий. Тем не менее, степень того, как низкие концентрации загрязняющих антибиотиков способствуют распространению резистентности в естественной среде, до конца не изучена. Этот механизм еще более усложняется ролью бактериофагов, обнаруженных среди микроорганизмов биопленок.