Международное сотрудничество позволило совершить важный прорыв в понимании генетических механизмов, которые позволяют бактериям вырабатывать резистентность к лекарственным препаратам.
Бактерии обладают множеством защитных механизмов, которые они могут использовать для формирования устойчивости к антибиотикам, что является одной из основных проблем, стоящих перед здравоохранением во всем мире. Один из этих механизмов это плазмиды - небольшие молекулы ДНК в бактериальных клетках, которые имеют свой собственный независимый геном и если удастся выяснить, какую роль играют плазмиды, то мы сможем использовать эту информацию для разработки нового поколения терапевтических средств, способных бороться с инфекциями, устойчивыми к антибиотикам.
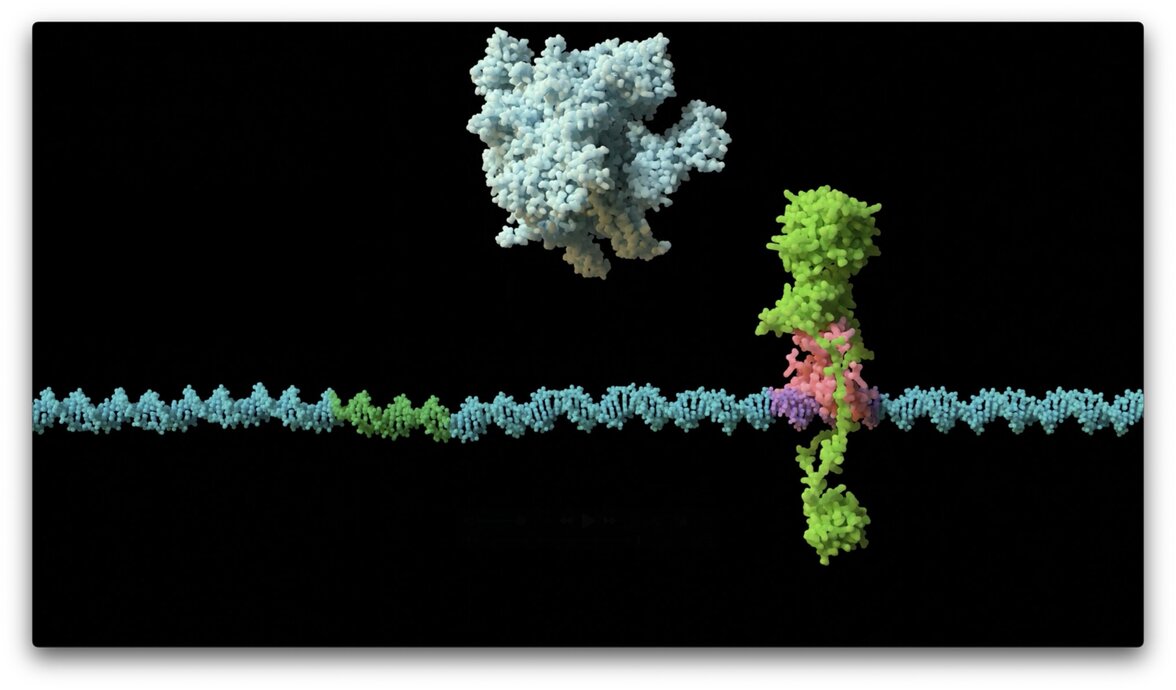
Исследователи Центра Джона Иннеса использовали модельную плазмиду под названием RK2, которая применяется во всем мире для изучения клинически значимых плазмид, передающих резистентность к противомикробным препаратам. Исследование «Переключение KorB с ДНК-скользящего зажима на репрессор опосредует глушение генов на большом расстоянии в плазмиде с множественной лекарственной устойчивостью» опубликовано в журнале Nature Microbiology.
Первоначальным объектом внимания авторов стала молекула под названием KorB, которая необходима плазмидам для выживания внутри бактерий-хозяев. Ранее было известно, что этот ДНК-связывающий белок играет роль в контроле экспрессии генов, но как это происходит, оставалось неясным. Используя передовые методы микроскопии и кристаллографии белков, исследователи обнаружили, что KorB взаимодействует с другой молекулой под названием KorA. Эта регуляторная система KorB-KorA останавливает экспрессию бактериальных генов: KorB действует как скользящий зажим ДНК, а KorA - как замок, удерживающий KorB на месте. Вместе этот комплекс блокирует экспрессию генов, чтобы сохранить плазмиду в бактерии.
Этот недавно открытый механизм позволяет по-новому взглянуть на процесс сайленсинга генов у бактерий, явление при котором регуляторные элементы, такие как комплекс KorB-KorA, могут взаимодействовать с удаленными целевыми генами, в данном случае выключая их, чтобы плазмида могла выжить. Первый автор исследования Томас Маклин рассказал, что это открытие - торжество науки, движимой любопытством. "Изначально наш проект был нацелен на изучение KorB. Затем удачный эксперимент, который был проведен исключительно из любопытства, привел нас к обнаружению способности KorA зажимать KorB в нужном месте в нужное время. Это был огромный прорыв, который кардинально изменил направление проекта. Наше исследование открывает новую парадигму бактериальной регуляции генов и предлагает мишень для новых терапевтических средств, позволяющих дестабилизировать плазмиды в их хозяевах и сделать их вновь чувствительными к антибиотикам".
Это исследование решает десятилетнюю загадку в этой области: как критический белок KorB контролирует включение и выключение генов в мультирезистентной плазмиде RK2 в бактериях. В настоящее время исследование расширяется, чтобы включить в него другие клинически значимые плазмиды и глубже изучить механизм KorB-KorA, чтобы понять, как он отключается.