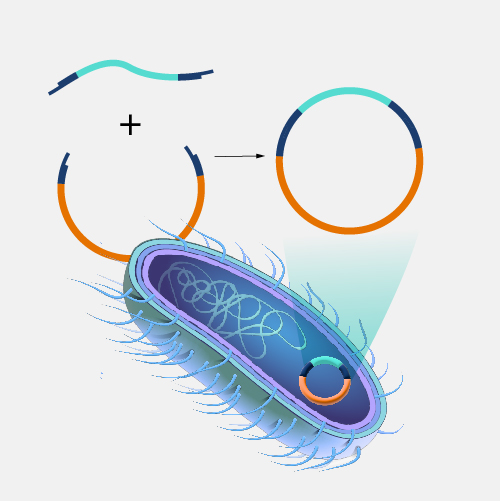
Использование белков бактериальной поверхности для манифестации различных бактериальных или вирусных эпитопов является интересным и перспективным подходом в разработке вакцин.
Комбинация антигенов вакцин-кандидатов и подходящих белков бактериальной поверхности может образовывать мощные структуры для антиген-специфической иммунной стимуляции. Используя редактирование CRISPR/Cas9, авторы недавнего исследования, опубликованного в журнале Microbial Cell Factories, стремились разработать вакцину, экспрессирующую мембранно-проксимальный внешний регион (MPER) оболочки ВИЧ-1 на поверхности E. coli.
«Применяя передовые технологии, мы вставили последовательности ДНК в определенный участок E. coli. Мы использовали часть вируса ВИЧ, которая не является инфекционной, но при этом заставляет организм вырабатывать нейтрализующие антитела", - рассказал соавтор работы Николай Щербак, доцент биологического факультета Университета Эребру (Швеция).
Белки наружной мембраны E. coli играют важную роль в адаптации бактерий к стрессу и внутриклеточном метаболизме, определяя фенотипы бактерий. Внешняя мембрана E. coli - это один из двух липидных слоев, окружающих бактериальную клетку. C внешней мембраной связано множество белков, включая порины (OmpF), которые участвуют в ряде функций, таких как диффузия ионов и малых молекул.
Эпитоп MPER ВИЧ-1 был успешно внедрен авторами в порин OmpF бактерии E. coli Nissle 1917 (EcN-MPER), и модификация оставалась стабильной в течение 30 пассажей рекомбинантной бактерии на уровне ДНК и белка. Кроме того, введенный эпитоп был распознан человеческими анти-ВИЧ-1 антителами с использованием как живого, так и термически убитого EcN-MPER, и эта антигенность также сохранялась в течение 30 пассажей. Дот-блоттинг показал более сильное связывание анти-HIV-1 антител с термически убитыми EcN-MPER, чем с их живыми аналогами. Везикулы наружной мембраны - богатый экстракт из супернатанта культуры EcN-MPER был одинаково антигенным для анти-HIV-1 антител, что предполагает, что антиген MPER может быть заключен в везикулы наружной мембраны EcN-MPER. Используя количественный метод ИФА, авторы определили, что количество MPER, продуцируемого модифицированным EcN, составляет 14,3 мкг/108 КОЕ.
Таким образом, исследователи показали, что технология CRISPR/Cas9 является эффективным методом создания рекомбинантных бактерий, стабильных в течение многих пассажей. Созданный клон был лишен посторонних плазмид и генов резистентности к антибиотикам, что исключает риск передачи плазмид в организм хозяев, если этот клон будет использоваться в качестве вакцины. Кроме того, клон EcN-MPER распознавался анти-ВИЧ-1 антителами как живыми, так и термически убитыми бактериями, что делает его пригодным для доклинической оценки.
Экспрессия OmpF на поверхности бактерий и высвобождающихся везикул наружной мембраны делает его привлекательным кандидатом для рекомбинантной модификации эпитопов, позволяющей представлять поверхностные эпитопы как на бактериях, так и на везикулах наружной мембраны. Применяя методы, описанные в данном исследовании, авторы представили потенциальную платформу для экономически эффективной и рациональной экспрессии и введения вакцинных антигенов, что открывает многообещающие перспективы для дальнейших исследований в области разработки вакцин.