Хотя у многих людей с расстройствами аутистического спектра также наблюдается необычное воспаление желудочно-кишечного тракта, не ясно как эти состояния могут быть связаны между собой.
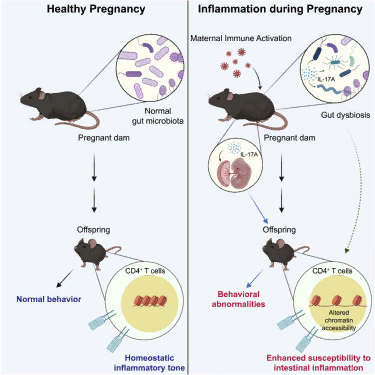
Однако исследователи Гарвардской медицинской школы и Массачусетского технологического института, работая с мышиными моделями, возможно, нашли эту связь: когда мать подвергается инфекции во время беременности и ее иммунная система вырабатывает повышенный уровень интерлейкина-17a (IL-17a), это может не только изменить развитие мозга плода, но и изменить его микробиом таким образом, что после рождения иммунная система новорожденного может стать предрасположенной к будущим воспалительным атакам.
В ходе четырех экспериментов, начатых в 2016 году, авторы исследования проследили, как повышенный уровень IL-17a во время беременности воздействует на нейронные рецепторы в определенной области мозга плода, что приводит к аутистическим поведенческим симптомам в мышиных моделях. Новое исследование, опубликованное недавно в журнале Immunity, показывает, как IL-17a может действовать, чтобы также изменить траекторию развития иммунной системы.
"Мы показали, что IL-17a, действуя на мозг плода, может вызывать аутистически-подобные поведенческие фенотипы, такие как социальный дефицит", - говорит соавтор работы Марк Хайман. "Теперь мы показываем, что тот же IL-17a у матерей, благодаря изменениям в микробиоме, вызывает сопутствующие симптомы, такие как активизация иммунной системы".
Исследователи предупреждают, что результаты исследования еще предстоит подтвердить на людях, однако они указывают на то, что проблемы центральной нервной и иммунной систем у людей с расстройствами аутистического спектра имеют общую природу: материнская инфекция во время беременности.
"До сих пор не было понимания того, почему у пациентов с неврологическими расстройствами нарушена работа иммунной системы", - говорит Хайман. "Мы связали эти разрозненные звенья воедино. Возможно, причина в том, что во время беременности они были подвержены усилению воспаления".
Исследовательская группа впервые подтвердила, что материнская иммунная активация (MIA) приводит к повышенной восприимчивости к кишечному воспалению у потомства, введя беременным мышам poly(I:C), вещество, имитирующее вирусную инфекцию. Их потомство, но не потомство матерей из контрольной группы, не подвергшихся воздействию, проявило симптомы, похожие на аутизм, как и ожидалось, а также воспаление кишечника при воздействии других воспалительных стимулов.
В то время как отклонения в нейроразвитии, которые отследила группа, происходят, когда плод еще находится в утробе матери, было неясно, когда формируются измененные иммунные реакции. Чтобы выяснить это, специалисты поменяли детенышей мышей местами при рождении: детенышей, родившихся у матерей с MIA, воспитывали контрольные матери, а детенышей, родившихся у контрольных матерей, воспитывали матери с MIA. Было обнаружено, что у мышат, рожденных матерями MIA, но воспитанных контрольными матерями, наблюдались симптомы аутизма, но не воспаление кишечника. У детенышей, рожденных контрольными матерями, но воспитанных матерями MIA, симптомы аутизма не проявлялись, но наблюдалось воспаление кишечника. Результаты показали, что если нейроразвитие нарушается до рождения, то иммунный ответ нарушается после родов.
Затем встал вопрос о том, каким образом MIA-мамы оказывают такое постнатальное воздействие на детенышей. Другие исследования показали, что материнский микробиом может влиять на развитие иммунной системы потомства. Чтобы проверить, так ли это в случае с моделью MIA, исследователи изучили фекалии мышей с MIA и контрольных мышей и обнаружили, что разнообразие микробных сообществ значительно отличалось.
Затем, чтобы определить, играют ли эти различия причинную роль, они вывели новую группу самок мышей в "безмикробной" среде и затем провели фекальную трансплантацию от матерей с MIA или контрольных самок этим безмикробным мышам и скрестили их с самцами. В отличие от контрольной группы, у детёнышей, родившихся от матерей, которым были трансплантированы фекалии MIA, наблюдалось воспаление кишечника. Эти результаты показали, что измененный микробиом матерей с MIA приводит к иммунизации потомства.
Среди заметных различий в реакции кишечного воспаления, которые исследователи измерили, было увеличение выработки IL-17a Т-клетками иммунной системы. IL-17a - это тот же самый цитокин, уровень которого повышается у матерей с MIA. Когда ученые изучили Т-клетки потомства, подвергшегося воздействию микробиома MIA, в сравнении с контрольным потомством, они обнаружили, что у потомства, подвергшегося воздействию микробиома MIA, CD4 Т-клетки чаще дифференцировались в Th17-клетки, которые высвобождают IL-17a.
Это побудило их обратить внимание на возможные различия в том, как CD4 T-клетки разных групп транскрибируют свои гены. CD4 Т-клетки, подвергшиеся воздействию MIA-микробиома, демонстрировали более высокую экспрессию генов активации Т-клеток, что говорит о том, что они были более подготовлены к Т-клеточно-зависимым иммунным реакциям в ответ на инфекции.
"Таким образом, повышение уровня IL-17a у матерей во время беременности приводит к предрасположенности к выработке большего количества IL-17a у потомства в ответ на иммунный вызов",
- резюмирует Хайман.
Установив, что иммунная система потомства может неправильно стимулироваться в результате воздействия измененного микробиома матери, которая была инфицирована во время беременности, оставалось выяснить, как этот микробиом становится измененным. Подозревая влияние IL-17a, исследователи проверили действие антител, блокирующих этот цитокин. Когда они блокировали IL-17a у матерей до иммунной активации, у их потомства не наблюдалось воспаления кишечника в более позднем возрасте. Это также подтвердилось, когда исследователи повторили эксперимент по пересадке фекалий MIA свободным от микробов самкам, на этот раз включив в него фекалии от MIA-матерей с блокаторами IL-17a. И снова блокирование IL-17a на фоне материнской инфекции привело к формированию микробиома, который не вызывал неправильного формирования иммунной системы потомства.
По словам Хаймана, полученные результаты свидетельствуют о том, что воздействие окружающей среды во время беременности, например, инфекция, может иметь долгосрочные последствия для здоровья потомства, и эта проблема всегда существовала, но может усугубиться в связи с пандемией Covid-19. По его словам, необходимы дальнейшие исследования, чтобы определить долгосрочные последствия для детей, родившихся от матерей, инфицированных SARS-Cov-2.
Он добавил, что возникающие связи между воспалением и нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, также могут потребовать дальнейшего изучения, учитывая полученные группой результаты о том, как материнская инфекция может привести к усилению воспаления у потомства.
