Вирусы, инфицирующие бактерии, повсеместно распространены даже среди бактериальных патогенов.
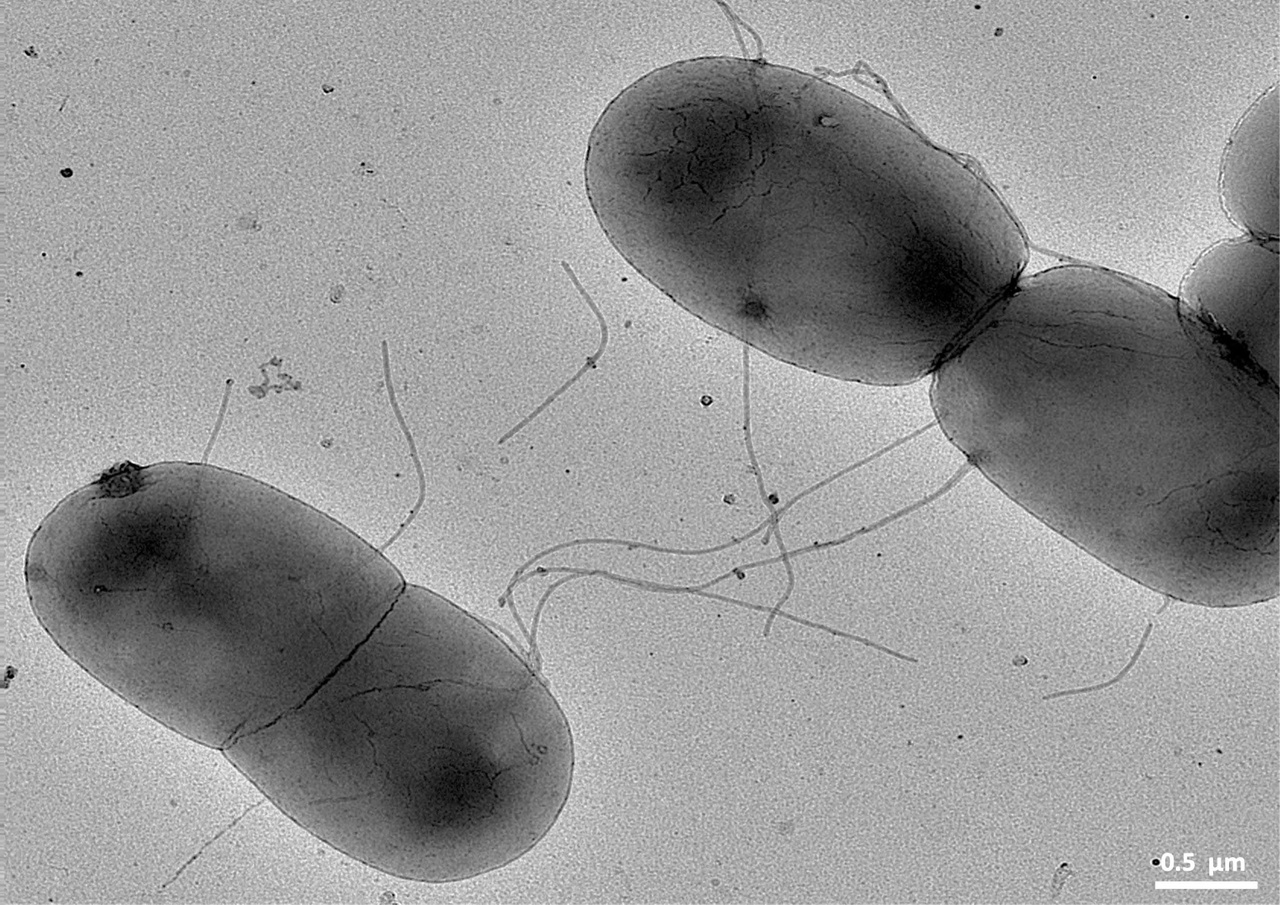
Распространенность антибиотикорезистентных инфекций Pseudomonas делает их объектом практического внимания для фаговой терапии. Одним из факторов, позволяющих P. aeruginosa передавать друг другу гены резистентности к противомикробным препаратам, а также перемещаться и создавать трудно поддающиеся лечению биопленки, является придаток, называемый пилусом, что в переводе с латинского означает "копье". Pseudomonas aeruginosa обладает множеством потенциальных факторов вирулентности, включая втягивающийся пилус, который приводит клетку в движение. Эти цилиндрические структуры отходят от поверхности бактерий.
Ретрактивные пили у бактерий играют важную роль в многочисленных биологических процессах, таких как перенос ДНК и белков, подвижность, адгезия, поверхностное зондирование, формирование биопленок и патогенез. Одноцепочечные РНК (ssRNA) бактериофаги - это небольшие вирусы, которые специфически нацелены на эти ретрактивные пили. Имея небольшой геном положительно заряженной РНК длиной около 4000 нуклеотидов, ssRNA-фаги обычно кодируют четыре белка: белок созревания (Mat), белок оболочки, РНК-зависимую РНК-репликазу и одногенный белок лизиса. Mat имеет решающее значение для созревания фага и распознавания пилуса. Однако то, как ssRNA-фаги используют взаимодействие Mat и пилуса для проникновения в клетку хозяина, остается загадкой на протяжении более чем шести десятилетий с момента открытия первого ssRNA-фага.
В своем исследовании, главным автором которого стал сотрудник Техасского университета A&M Джирапат Тонгчол, ученые исследовали этот процесс шаг за шагом с помощью флуоресцентной микроскопии, криогенно-электронной микроскопии и вычислительного моделирования. Они наблюдали, как фаг под названием PP7 заражает P. aeruginosa, прикрепляясь к пилусу. Пилус втягивается и притягивает фаг к поверхности бактериальной клетки. В точке проникновения вируса в клетку пилус сгибается и отщелкивается, тем самым лишая бактерию способности заражать своего хозяина..
Эта работа является продолжением предыдущего исследования, опубликованного в 2020 году, когда эта же группа ученых обнаружила фаг, способный аналогичным образом отламывать пилусы клеток E. coli, не позволяя бактериям обмениваться генами между собой. Исследование Pseudomonas является частью недавней серии научных работ этой группы исследователей. В марте 2024 года они опубликовали в журнале Nature Communications результаты исследования взаимодействия между другим родом бактерий, Acinetobacter, и фагом, который его заражает. Еще одно исследование, публикация которого ожидается в мае 2024 года, будет посвящено третьему роду бактерий и еще одному фагу.
"В нашем предыдущем исследовании, посвященном E. coli, мы не очень подробно изучили этот механизм", - рассказал Тонгчол. "В исследовании Pseudomonas мы смогли понять гораздо больше о том, что именно происходит, включая силу и скорость отсоединения пилуса, и разобраться, почему и как это происходит". Результаты этого исследования могут оказаться важными для лечения резистентных инфекций. По словам Тонгчола, врачам не нужно будет использовать фаги для уничтожения бактерий, как это делается в фаговой терапии, а можно просто позволить вирусам обезвредить бактерии, что может дать иммунной системе возможность самостоятельно бороться с инфекцией или позволить врачам лечить пациентов меньшими дозами антибиотиков.
"Если вы просто убьете бактерии, вы разрушите клетки, и они начнут выделять токсины в организм хозяина", - объясняет Тонгчол. "Наш подход заключается в использовании особого типа фага, который обезвреживает бактерии. Мы лишаем их возможности обмениваться генами резистентности или передвигаться, отрывая эти пили". Авторы сообщили, что продолжат поиски подобных примеров, когда фаги ослабляют вирулентность патогенных бактерий. "Мы используем синергетический подход", - сказал Тонгчол. "Мы пытаемся понять универсальный механизм действия этого типа фагов и то, как они способны влиять на другие типы бактерий. Такова главная цель нашей совместной работы: попытаться решить проблему бактерий с множественной лекарственной резистентностью".