Исследование, опубликованное в журнале Nature, показывает, что ранний период жизни является критическим временем, когда иммунная система учится распознавать кишечные бактерии и устанавливает над ними контроль. Дефекты в этом механизме могут помочь объяснить, почему иммунная система иногда атакует хорошие бактерии в неправильном месте, вызывая хроническое воспаление.
"С момента нашего рождения наша иммунная система настроена таким образом, чтобы научиться как можно лучше отличать хорошее от плохого", - говорит соавтор исследования Мэтью Беттини. "Наши исследования показывают, что существует окно, в котором микробиота кишечника имеет доступ к процессу обучения иммунитета. Это открывает возможности для разработки терапевтических средств, которые могут влиять на траекторию развития иммунной системы в этот ранний период".
Пытаясь понять, как организм поддерживает здоровые отношения с бактериями, Беттини и коллеги исследовали, как микробиота кишечника формирует развивающуюся иммунную систему. Они обнаружили, что специализированные иммунные клетки захватывают части бактерий и переносят их на большие расстояния от кишечника до тимуса, отвечающий за "воспитание" Т-клеток. Доставка груза побуждает тимус вырабатывать Т-клетки, нацеленные на микробиоту. Затем Т-клетки выходят из тимуса и обследуют лимфатические узлы, кишечник и другие участки, чтобы держать бактерии под контролем. Ученые определили эти этапы, засеяв кишечник мышей определенным типом бактерий. В ответ тимус вырабатывал Т-клетки, которые специфически распознавали эти бактерии. Однако как это происходит, исследователи не понимали.
Обнаружение ДНК бактерий в тимусе и лимфатических узлах стало первой подсказкой, что микробиота мигрировала в эти места. Чтобы проследить их путь, исследователи использовали специальную линию мышей, клетки которых флуоресцировали красным цветом после облучения лазером. В течение двух дней после фотоактивации красные клетки кишечника, в конечном счете, добрались до тимуса, лимфатических узлов и селезенки. Эти процессы были устойчивыми в течение первых недель жизни, но значительно ослабли к тому времени, когда мыши достигли зрелого возраста. "Наше исследование опровергает прежние предположения о том, что потенциальные патогены не оказывают влияния на иммунные клетки, развивающиеся в тимусе", - объясняет Беттини.
"Вместо этого мы видим, что существует окно возможностей для тимуса учиться у этих бактерий. Даже если эти события происходят в раннем возрасте, они могут оказать большее влияние в более позднем возрасте".
Эта идея стала очевидной, когда выяснилось, что Т-клетки, запрограммированные на борьбу с полезными бактериями, могут выполнять двойную функцию защиты от близкородственных "плохих" бактерий. Мыши, зараженные E.coli в раннем возрасте, имели более чем в шесть раз больше шансов выжить после смертельной дозы сальмонелл в более позднем возрасте. Полученные результаты позволяют предположить, что формирование иммунитета к микробиоте также создает защиту от патогенных бактерий, с которыми организму еще предстоит столкнуться. Изучение этих ранних коммуникаций между организмом и микробиотой показывает, насколько важно с самого начала подготовить иммунную систему, говорит Беттини. "Это раннее обучение иммунных Т-клеток абсолютно необходимо для быстрого развития широкого репертуара клеток для нашей защиты".
"Мы считаем, что наши результаты могут быть использованы в тех областях исследований, где определенные бактерии были признаны либо протективными, либо патогенными при других заболеваниях, таких как диабет 1 и 2 типа", - говорит Беттини. "Теперь мы задаемся вопросом, будет ли это окно воздействия бактерий и развития Т-клеток также важно для возникновения этих заболеваний?".
Daniel F. Zegarra-Ruiz et al. Развитие в тимической ткани кишечных микробиота-специфичных Т-клеток (аннотация).
Между человеком и его микробиотой сложились взаимовыгодные отношения, в которых человек-хозяин обеспечивает благоприятную среду для микроорганизмов, а микробиота обеспечивает множество преимуществ для хозяина, включая питательные преимущества и защиту от патогенной инфекции. Поддержание этих взаимоотношений требует тщательного иммунного баланса для удержания комменсальных микроорганизмов в просвете кишечника при одновременном ограничении воспалительных антикомменсальных реакций.
Антиген-специфическое распознавание кишечных микроорганизмов Т-клетками было описано ранее. Хотя местная среда формирует дифференцировку эффекторных клеток, остается неясным, как микробиота-специфические Т-клетки образуются в тимусе. В данном исследовании мы показали, что колонизация кишечника в раннем возрасте приводит к переносу микробных антигенов из кишечника в тимус кишечными дендритными клетками, которые затем вызывают экспансию микробиота-специфических Т-клеток. Попадая на периферию, микробиота-специфические Т-клетки обладают патогенным потенциалом или могут защищать от соответствующих патогенов.
Таким образом, развивающаяся микробиота формирует и расширяет репертуар тимических и периферических Т-клеток, позволяя улучшить распознавание кишечных микроорганизмов и патогенов.
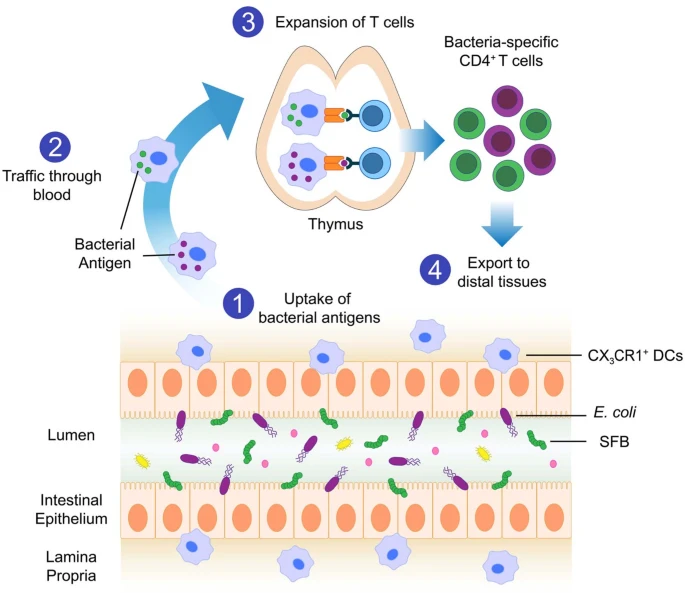
Мы предполагаем, что CX3CR1+ дендритные клетки захватывают кишечные комменсальные микроорганизмы (1) и мигрируют в тимус (2), где они презентируют бактериальные антигены CD4+ Т-клеткам. Это вызывает экспансию бактериоспецифических CD4+T-клеток (3), которые затем экспортируются в периферические органы (4).
