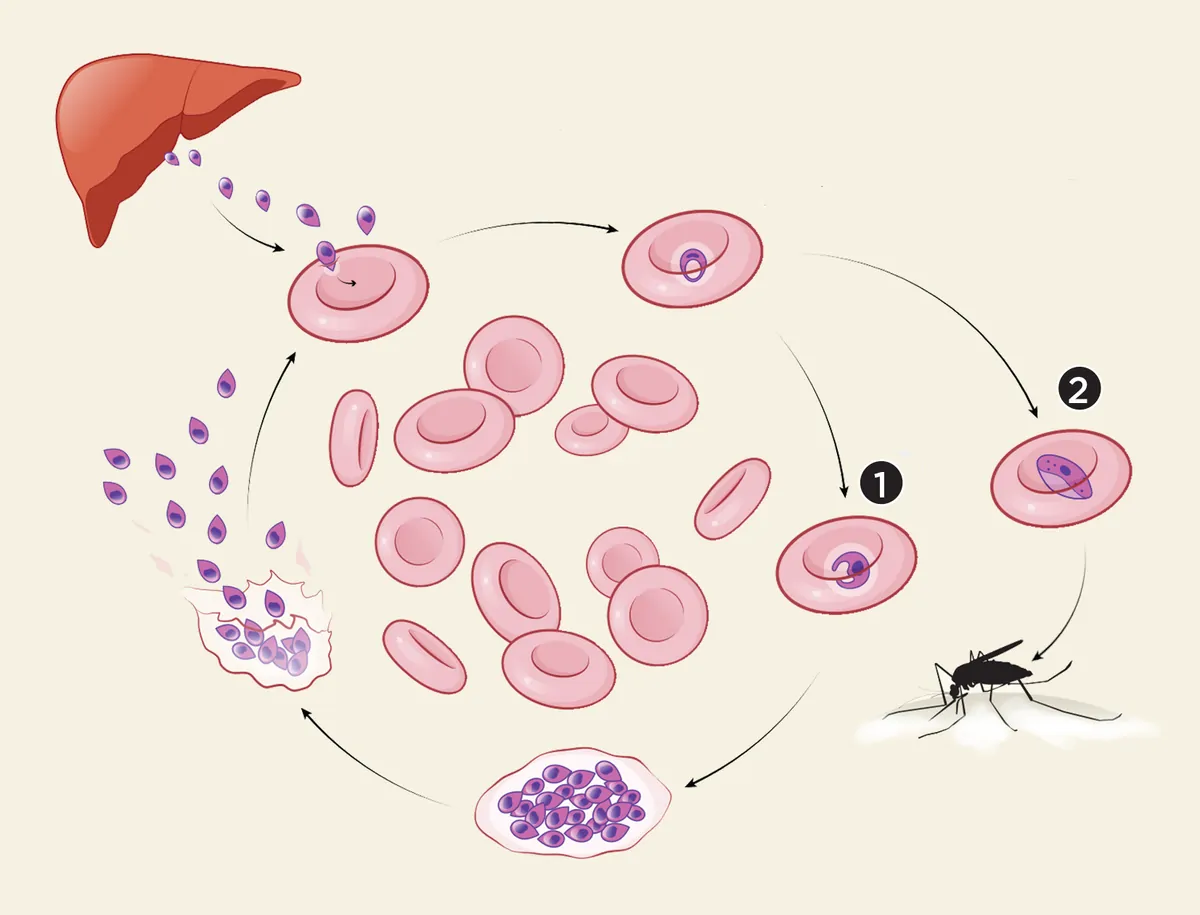
Малярия - одна из самых смертоносных болезней в мире, только в 2020 году от нее умерло 627 000 человек.
Гипогликемия является клиническим признаком тяжелой малярии, которая часто приводит к летальному исходу при заражении Plasmodium falciparum. Это осложнение особенно опасно для детей и может привести к летальному исходу, если его не лечить, но почему оно развивается долгое время оставалось загадкой. В исследовании, опубликованном в 15 июля в журнале Cell Metabolism, ученые описывают сложное перетягивание каната между хозяином и паразитом, которое, по-видимому, объясняет гипогликемию, вызванную малярией.
Исследователи объясняют, что и хозяин, и паразит демонстрируют адаптивное поведение во время этого процесса. По их словам, хозяин избавляется от паразита, снижая уровень сахара в крови, а паразит становится менее вирулентным, пытаясь сохранить жизнь и себе, и хозяину достаточно долго, чтобы дать начало следующему поколению. "Идея о том, что патоген жестко запрограммирован быть опасным, как бы исчезает, - говорит соавтор исследования Мигель Соарес, иммунолог из Института Гюльбенкяна в Португалии, - "патогены - это просто микроорганизмы, которые пытаются адаптироваться и выжить".
"Это отличная статья, очень хорошая работа", - говорит иммунопатолог Филипп Ван ден Стин, исследователь из Института Рега, который не принимал участия в исследовании. "Это то, что в настоящее время действительно не очень хорошо изучено... [Почему] у пациентов с тяжелой формой малярии действительно нарушается метаболизм".
Плазмодии, вызывающие малярию, имеют сложный жизненный цикл. Они переносятся комарами между хозяевами, некоторое время созревают в клетках печени, а затем в конце концов оказываются в эритроцитах. Попав туда, паразиты размножаются, питаясь гемоглобином. Далее они могут пойти по одному из двух путей: они могут по сути клонировать себя, создавая больше паразитов, инфицирующих клетки крови, или же они могут генерировать гаметы, которые спокойно ждут, пока их не проглотит другой комар, чтобы стать следующим поколением паразитов и заразить других хозяев.
Первый путь позволяет паразитам в конечном итоге произвести больше гамет, но тем временем зараженные эритроциты лопаются, высвобождая в кровь молекулу гема, переносящую кислород (гем — простетическая группа железосодержащих белков (гемоглобина, миоглобина цитохромов, пероксидазы, каталазы и др.) - прим.ред.). Гем, в свою очередь, отвечает за несколько тяжелых симптомов малярии.
Исследование началось с того, что Соарес и коллеги заинтересовались ролью гема при малярии. Они заметили, что у мышей, зараженных Plasmodium (либо P. chaubadi chaubadi, либо P. falciparum), наблюдались те же симптомы, что и у людей, инфицированных этими паразитами: они переставали питаться, и уровень сахара в их крови падал вместе с количеством эритроцитов. По мере исчезновения эритроцитов мыши также переставали вырабатывать генетические инструкции для ключевого фермента, вырабатывающего глюкозу, под названием G6PC1 в клетках печени.
Авторы предположили, что гем может быть ответственен за снижение производства глюкозы в печени. Они обнаружили, что введение гема нормальным мышам воссоздает симптомы инфекции, включая низкий уровень сахара в крови. Эти мыши также переставали есть, лишаясь внешнего источника глюкозы. Когда ученые изучили гены, экспрессируемые в клетках печени во время инфекции и после введения гема, они обнаружили схожие изменения в профилях экспрессии, особенно для генов, связанных с метаболизмом.
"Группы гема ... поступают в печень, и они не дают печени производить глюкозу", - объясняет Соарес. "Они прекрасно показали, что гем, который является результатом жизнедеятельности паразита, может быть ответственен за снижение выработки глюкозы печенью", - говорит Ван ден Стин. Гем "оказывается действительно важной молекулой и оказывает большое влияние на производство глюкозы в печени".
Далее исследователи хотели разобраться, как низкий уровень сахара в крови хозяина влияет на паразита. Они использовали трансгенных мышей, у которых в печени не экспрессируется ген G6PC1, то есть они вообще не могут вырабатывать глюкозу посредством этого органа. У этих мышей количество инфицированных эритроцитов было ниже, чем у контрольных мышей, что указывает на то, что низкая выработка глюкозы печенью приводит к условиям, менее благоприятным для P. falciparum.
В дальнейших экспериментах ученые провели секвенирование мРНК единичных клеток P. falciparum трансгенных и контрольных мышей и обнаружили, что в отсутствие выработки глюкозы печенью, Plasmodium начинает производить гаметы вместо инфицирующих клетки крови копий себя - развитие бесполых стадий Plasmodium останавливается через механизм, связанный с дисфункцией митохондрий паразита. Паразит также прекращает активную транскрипцию генов вирулентности.
"Plasmodium очень сильно зависит от глюкозы", - говорит Соарес. Как только уровень глюкозы в организме хозяина снижается, паразит "начинает погибать и ему нужно выбраться из хозяина". . . . Гипогликемия, связанная с малярией, представляет собой компромисс между стратегией защиты, основанной на гипометаболизме, которая уравновешивает вирулентность паразита и передачу инфекции", - заключает он.
Иммунолог Дьянн Вирт из Гарвардской школы общественного здравоохранения, которая не принимала участия в этой работе, говорит, что это "довольно интересно" и "хорошее дополнение к литературным данным", однако она не уверена, насколько применимы мышиные модели к человеку. Она обеспокоена тем, что количество инфицированных эритроцитов в мышиных моделях "очень велико по сравнению с тем, что происходит при большинстве клинически значимых инфекций у человека".
Авторы признают, что их работа должна быть подтверждена на людях, но считают, что полученные результаты могут помочь улучшить результаты лечения в отдаленном будущем. Соарес предполагает, что результаты показывают, что "возможно, трудно лечить людей, просто давая им глюкозу или не давая ее", потому что доставка жизненно важной глюкозы может обострить инфекцию. И хотя он подчеркивает, что эта работа является фундаментальным исследованием, он надеется, что ученые смогут "адаптировать эти знания и воплотить их" в будущих методах лечения.