Бактерии могут остановить фагов, совершая акт альтруистического самоубийства.
Бактерии и бактериофаги, которые их инфицируют, участвуют в бесконечной эволюционной борьбе. "Из-за этой постоянной войны каждая сторона выработала сложные механизмы, чтобы уничтожить другую", - говорит Майкл Лауб, иммунолог из Массачусетского технологического института. В недавней работе, опубликованной в журнале Nature, Лауб и его коллеги сообщили, что белок фага, называемый основным капсидным белком, индуцирует механизм прерывания инфицирования, или запрограммированного самоубийства бактерий, взаимодействуя с бактериальным белком CapRel.
CapRel участвует в системе защиты, которая защищает E.coli от фагов. Лауб и его коллеги определили структуру белка CapRel и обнаружили, что он состоит из двух доменов: N-концевого токсинового домена и C-концевого антитоксинового домена. Антитоксиновый домен действует как датчик фага. Когда фаги находятся вне поля зрения, антитоксиновый домен не дает токсиновому домену убивать бактерии.
Во время фаговых инфекций антитоксиновый домен связывается с основным капсидным белком фага. Это связывание приводит к структурным изменениям в CapRel, которые высвобождают токсиновый домен. Когда происходит это структурное изменение, белок CapRel останавливает синтез белка в инфицированной клетке. Синтез нового белка жизненно важен для жизни фага и бактерии, и его остановка убивает и бактерию, и заражающие ее частицы фага. Самоубийство клеток может показаться нелогичным защитным механизмом, однако бактерии используют его для того, чтобы фаги не продолжали размножаться и инфицировать другие клетки. Хотя ученым было известно о таком виде клеточной смерти, сам механизм оказался несколько неожиданным.
"Можно утверждать, что есть смысл в том, что [мишенью CapRel] является капсидный белок - то, что вирус должен производить и что потенциально трудно мутировать. Но с другой стороны, капсидные белки - это то, что фаги производят относительно поздно во время инфекции, - объясняет Лауб. Как только фаги начинают производить эти белки, бактериям, по-видимому, уже слишком поздно действовать". По словам Джозефа Бонди-Деноми, микробиолога и иммунолога из Калифорнийского университета, который не участвовал в данном исследовании, этот защитный механизм показывает, что "бактериальный иммунитет достаточно сложен, чтобы распознавать важные белки бактериофагов, убивая клетки чуть раньше, чем фаг хочет, чтобы они погибли".
Хотя вполне возможно, что механизм распознавания фагов CapRel может распространиться на другие взаимоотношения бактерий и фагов, "очень возможно, что этот конкретный механизм составляет меньшинство систем CapRel, а большинство из них на самом деле работают по-другому", - считает Бонди-Деноми. Тем не менее, по его словам, это "была довольно тщательная и глубокая работа, которая проверяет многие аспекты".
Гонка вооружений между бактериями и фагами вызвала интерес к таким приложениям, как фаговая терапия, когда ученые используют фаги для борьбы с бактериальными инфекциями у людей. Хотя концепция захватывающая, успех такой терапии еще не доказан. "Когда [терапия] не работает, одна из возможностей заключается в том, что существует защитная система, которая блокирует активность фагов", - говорит Лауб.
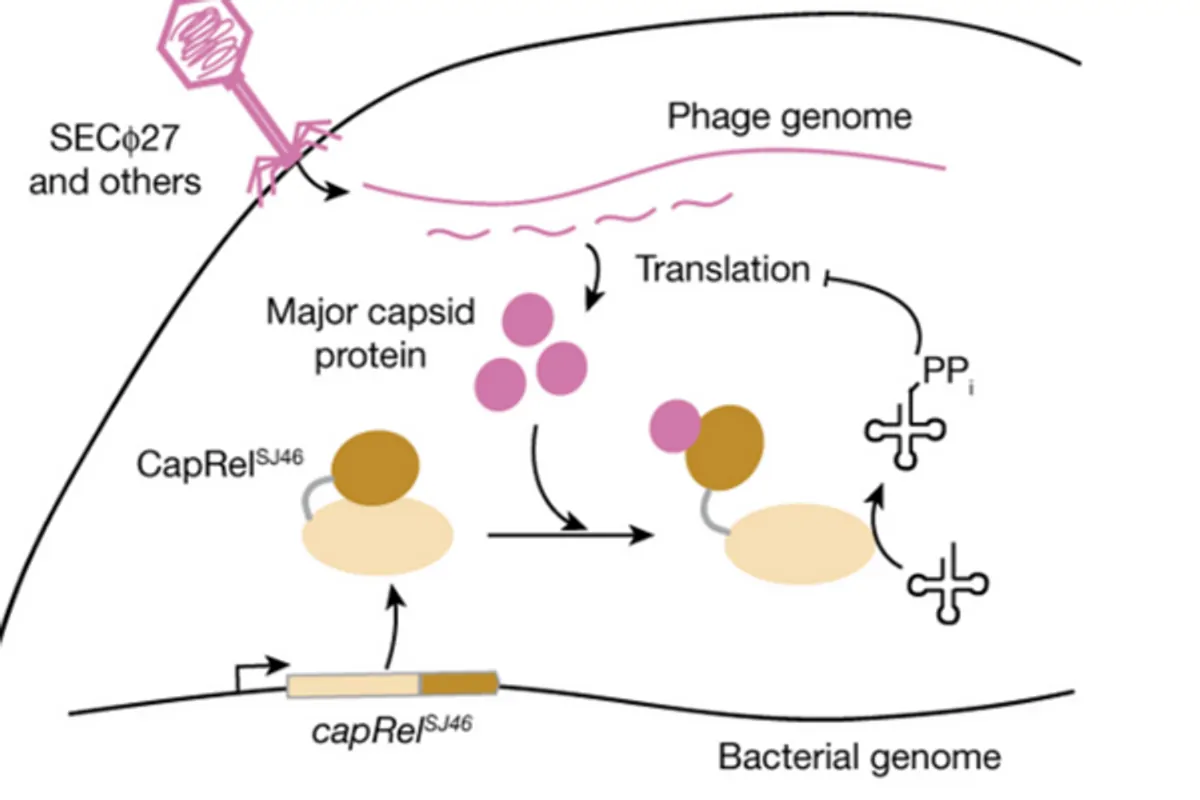
Взаимодействие бактериального белка CapRel с основным капсидным белком бактериофага для запуска механизма иммунной защиты. Иллюстрация: Nature.
По словам Джозефа ван Беллегема, иммунолога, работавшего ранее в Цюрихском университете и не участвовавшего в данном исследовании, понимание механизма, благодаря которому бактерии становятся устойчивыми к фагам, поможет в будущем использовать фаговую терапию. "Если мы сможем расшифровать, какой тип бактерий и какой тип фагов вызывает определенный механизм сопротивления, мы сможем сделать обоснованные предположения о том, какие фаги следует использовать".
В настоящее время существует лишь несколько случаев, когда ученые продемонстрировали прямое связывание между иммунным белком бактерий и структурным белком фага. Будущие открытия в области бактериальных иммунных систем могут дать больше знаний об иммунологии эукариот. "Это начало бурного развития противовирусных систем, обнаруживающих структурные белки. Существует очень много таких систем, основанных на сигналах малых молекул. Я предполагаю, что это приведет к появлению новых лекарственных препаратов", - считает Бонди-Деноми.
В настоящее время Лауб и его группа изучают способность CapRels защищаться от других неродственных фагов, чтобы понять, насколько консервативны или различны триггеры или активаторы в разных системах. "Существует просто огромное количество токсин-антитоксиновых систем. Так что нам есть чем заняться", - говорит он.