Новый метод скрининга единичных клеток позволяет оценить насколько хорошо антибиотики убивают бактерии и может помочь исследователям определить какие препараты лучше всего помогают пациентам.
Устойчивость к противомикробным препаратам является серьезной проблемой общественного здравоохранения, но это не единственная причина, по которой некоторые антибиотики не помогают. Некоторые бактерии, такие как микобактерии туберкулеза, могут противостоять лечению антибиотиками, не развивая резистентности, что называется толерантностью. Когда антибиотики просто блокируют рост бактерий, они могут затаиться на несколько месяцев, оставаясь бездействующими, но живыми.
Существующие тесты на эффективность антибиотиков в борьбе с инфекциями обычно направлены на оценку способности препаратов подавлять рост бактерий, а не убивать их. Это может привести к длительным курсам лечения и плохим результатам. Чтобы определить антибиотики, которые уничтожают бактерии сразу, Лукас Бек, биомедицинский исследователь из Базельского университета, и его коллеги недавно разработали рабочий протокол, названный антимикробным тестированием единичных клеток (antimicrobial single-cell testing - ASCT). Этот тест позволяет определить, насколько хорошо антибиотики убивают бактерии на уровне одной клетки. Описание данного метода, опубликованное в журнале Nature Microbiology, может помочь предсказать, насколько хорошо пациенты будут реагировать на лечение конкретными антибиотиками.
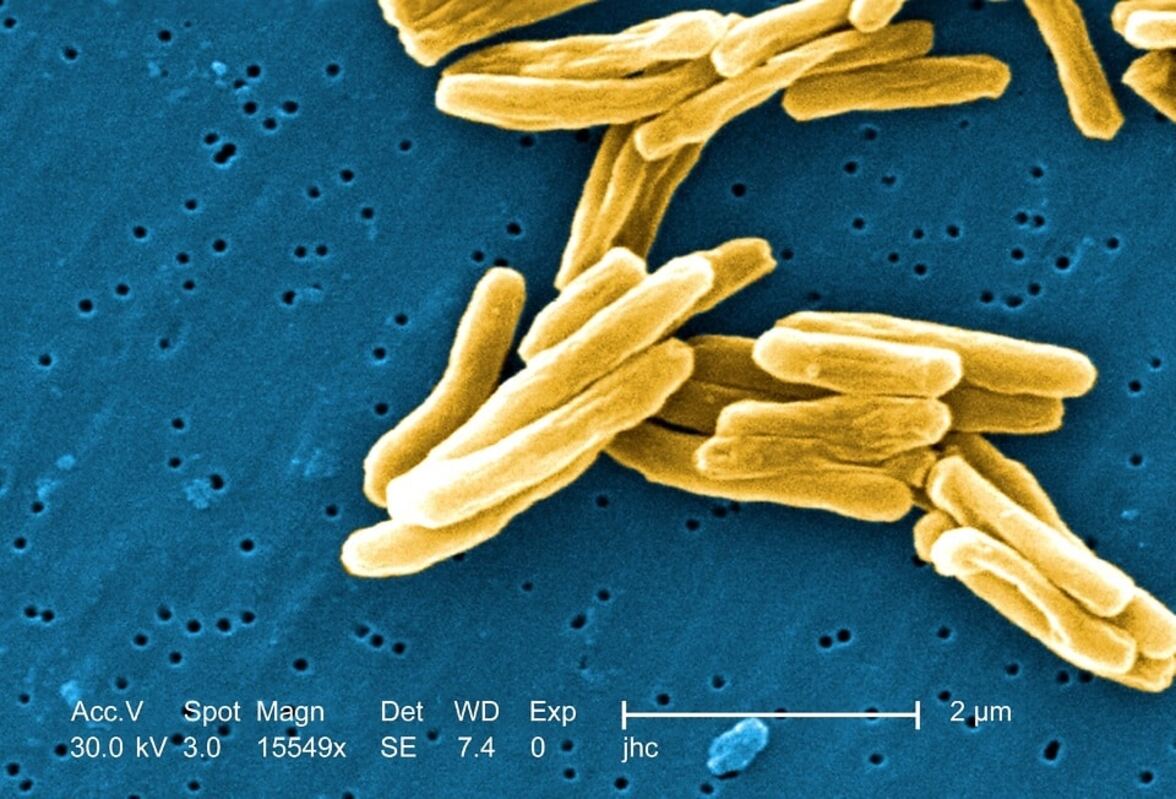
Чтобы продемонстрировать, как работает ASCT, исследователи поместили клетки Mycobacterium abscessus в планшет на 1536 лунок. Этот патоген, вызывающий легочную инфекцию, родственен M. tuberculosis, но для исследователей он представляет меньшую угрозу с точки зрения биобезопасности. Исследователи окрасили M. abscessus красителем, который сигнализирует о жизнеспособности, и воздействовали на бактерии восемью антибиотиками в течение трех дней. Чтобы отслеживать гибель бактерий, они делали снимки каждые два-четыре часа в течение трех дней и замеряли “кинетику замедления” для каждой клетки, показатель, демонстрирующий, насколько быстро каждый препарат убивает бактерии.
Затем ученые проверили, является ли ASCT более эффективным методом прогнозирования результатов лечения антибиотиками при инфекциях M. tuberculosis в живых организмах, чем при стандартном тесте ингибирования роста. Сначала они использовали ASCT для оценки того, насколько хорошо 65 комбинаций антибиотиков уничтожают два авирулентных штамма M. tuberculosis. Затем они использовали данные существующих исследований на мышах и людях и классифицировали комбинации антибиотиков в зависимости от того, насколько хорошо они смягчают инфекцию M. tuberculosis у мышей и людей по сравнению со стандартным режимом лечения. Исследователи обнаружили, что ASCT может различать препараты, которые “похожи на стандартные" и “лучше чем стандартные", но без определения ингибирование роста.
Чтобы лучше понять, как различные штаммы микобактерий переносят воздействие антибиотиков, Бек и коллеги изучили клинические изоляты M. abscessus от 405 пациентов. Они исследовали, насколько хорошо M. abscessus переносит восемь широко используемых антибиотиков в течение 72 часов, отслеживая в общей сложности более 100 миллионов отдельных клеток. Авторы обнаружили, что реакция изолятов на антибиотики отличалась друг от друга, что указывает на то, что различия в штаммах бактерий влияют на переносимость антибиотиков.
Бек надеется, что в один прекрасный день ASCT поможет персонализировать схемы приема лекарств для каждого пациента и патогена, с которым тот борется.
Alexander Jovanovic et al. Крупномасштабное тестирование летальности противомикробных препаратов с разрешением в одну клетку позволяет предсказать исход микобактериальной инфекции (аннотация).
Бактерии выработали различные стратегии преодоления токсического воздействия. Наиболее известной из них является устойчивость к антибиотикам, при которой генетические модификации изменяют место поражения или эффективную концентрацию лекарственного средства в месте поражения, способствуя росту бактерий во время медикаментозного лечения. Другая бактериальная стратегия предполагает кратковременное выживание бактерий во время лечения антибиотиками, что позволяет бактериям возобновить рост после прекращения действия препарата. Это явление известно как лекарственная толерантность, что означает замедленное уничтожение популяции в целом и персистенцию, когда присутствует субпопуляция с высокой толерантностью. Несмотря на десятилетия признания и выявления механизмов множественной толерантности, ключевые аспекты биологии толерантности, особенно при инфекциях человека, и ее влияние на лечение антибиотиками остаются недостаточно изученными.
Даже при отсутствии устойчивости к антибиотикам результаты лечения бактериальных инфекций, включая инфекции мочевыводящих путей, дыхательных путей и кровотока, часто являются неудовлетворительными. Эта проблема особенно остро проявляется при микобактериальных инфекциях, когда ограниченная эффективность лечения требует длительной комбинированной медикаментозной терапии, длящейся от месяцев до нескольких лет. Для лечения лекарственно-чувствительных микобактерий туберкулеза, которые в 2023 году стали причиной более 1 миллиона смертей потребовались десятилетия исследований, чтобы сократить сроки лечения с 6 до 4 месяцев. Такие длительные сроки лечения являются дорогостоящими, связаны с токсичностью, ассоциированной с лечением, и повышают риск несоблюдения пациентом схемы приема препарата, что может привести к рецидивам и передаче инфекции.
Терапевтическая проблема еще более остро стоит при инфекциях, вызванных Mycobacterium abscessus, которые в настоящее время являются одной из наиболее распространенных микобактериальных инфекций в развитых странах. Для лечения M. abscessus не существует стабильной эффективной лекарственной схемы и результаты лечения часто оставляют желать лучшего, причем частота неудач часто превышает 50%, несмотря на месяцы или годы лечения несколькими активными препаратами.
Этот разрыв между ингибированием роста in vitro и эффективностью in vivo побудил нас разработать стратегии, выходящие за рамки стандартного тестирования на чувствительность, для лучшего прогнозирования результатов лечения. Уничтожение бактерий может быть таким фактором, который не учитывается с помощью минимальных ингибирующих концентраций (MICs) и который было сложно изучить из-за трудоемкости и низкой производительности анализов на колониеобразующие единицы (КОЕ).
Чтобы преодолеть этот пробел, мы разработали антимикробное тестирование единичных клеток (ASCT) - масштабируемый метод количественной оценки жизнеспособности бактерий с разрешением в одиночные клетки. Мы впервые применили ASCT к микобактериям туберкулеза, чтобы изучить, связаны ли убивающие свойства различных схем приема лекарств с реакцией на лечение in vivo у мышей и людей. Применив этот подход к Mycobacterium abscessus, мы затем сравнили сотни клинических изолятов, чтобы определить, как вариабельность бактериального штамма влияет на динамику уничтожения антибиотиков и индивидуальные результаты лечения пациентов.
Мы продемонстрировали, что паттерны толерантности группируются по мишеням для антибиотиков, идентифицировали фаговый белок, который модулирует уничтожение антибиотиками, и показали, что динамика уничтожения, специфичная для конкретного штамма, связана с индивидуальными исходами у пациентов независимо от лекарственной устойчивости. В совокупности эти результаты создают основу, которая показывает, как свойства лекарств и разнообразие бактерий влияют на эффективность лечения, предлагая путь к более эффективным и персонализированным методам лечения.