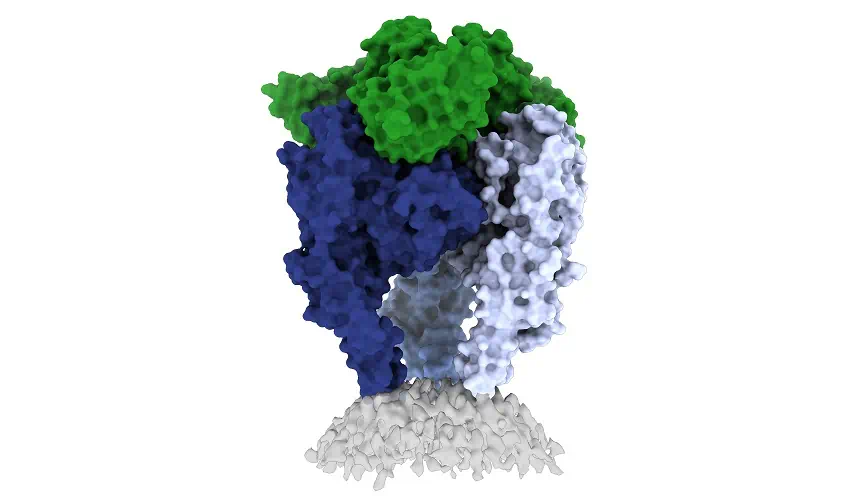
Бешенство - одна из самых страшных вирусных инфекций, при отсутствии лечения она почти на 100% летальна и ежегодно уносит жизни более 50 000 человек.
Хотя существуют высокоэффективные вакцины против бешенства, которые гораздо доступнее и проще в применении, чем лечение, они не обеспечивают пожизненного иммунитета. Ученые считают, что это может быть связано с белком на поверхности вируса - гликопротеином вируса бешенства, который меняет форму и затрудняет распознавание вируса антителами организма. В новом исследовании, опубликованном в журнале Science Advances, ученые впервые с высоким разрешением рассмотрели гликопротеин в его "тримерной" структуре, что может помочь в разработке лучших вакцин против бешенства в будущем.
"Бешенство - самый смертоносный вирус из всех известных нам", - говорит старший автор исследования Эрика Оллманн Сафир. Он является неотъемлемой частью нашей истории - мы живем с его призраком уже сотни лет. Однако ученые никогда не наблюдали за организацией его поверхностной молекулы. Важно понять эту структуру, чтобы создать более эффективные вакцины и методы лечения, а также понять, как бешенство и другие подобные ему вирусы проникают в клетки".
"Гликопротеин вируса бешенства - единственный белок, который экспрессируется на его поверхности, что означает, что он является основной мишенью нейтрализующих антител во время инфекции", - объясняет Сафир. "Но, подобно швейцарскому армейскому ножу, этот белок может менять свою форму: его части разворачиваются и откидываются наверх, когда это необходимо. Всего он может меняться между четырьмя формами: сложенной и развернутой конформациями, которые возникают до и после слияния с клеткой-хозяином, а также между тримерной структурой (когда три белка объединяются в пучок) и мономерной структурой (каждый белок сам по себе). Это является проблемой, поскольку человеческие антитела распознают только один участок на белке и не могут следовать за ним, когда он трансформируется, скрывая или перемещая эти участки".
Ученые задались целью получить более четкое представление о тримерной форме гликопротеина, которую он принимает перед тем, как инфицировать клетки человека. Для этого они стабилизировали и заморозили белок в тримерной форме, а затем соединили его с человеческим антителом, что помогло точно определить место, где вирусная структура уязвима для атак антител. Затем исследователи получили трехмерное изображение гликопротеина с помощью криогенной электронной микроскопии, что позволило выделить несколько ключевых особенностей, включая ту часть белка, которая переворачивается. Это два белка (называемые пептидами слияния), которые соединяют нижнюю часть гликопротеина с вирусной мембраной, а затем проецируются в клетку-мишень в процессе инфекции. Очевидно, что получить стабильное изображение этих структур очень сложно.
"Лучшее понимание структур вируса и того, как они распознаются иммунными антителами для нейтрализации вируса, всегда приветствуется, поскольку эта информация может позволить доработать и улучшить вакцины против этого вируса", - говорит Сафир. "В настоящее время вакцины против бешенства для людей и домашних животных изготавливаются из убитого вируса. Но этот процесс инактивации может привести к тому, что молекулы приобретают неправильную форму, поэтому эти вакцины могут быть не эффективны. Наши результаты дают основу для разработки улучшенных вакцин против бешенства на основе стабилизированной конформации".