Исследователи выявили новый бактериальный белок, который помогает доставлять компоненты для внешней мембраны Escherichia coli.
Окраска по Граму названа в честь Ганса Христиана Грама, который разработал эту методику в 1880-х годах. Позднее ученые обнаружили, что грамотрицательные бактерии не поглощают краситель, потому что их уязвимая клеточная мембрана защищена слоем плотно упакованных сахаров поверх которой находится внешняя мембрана.
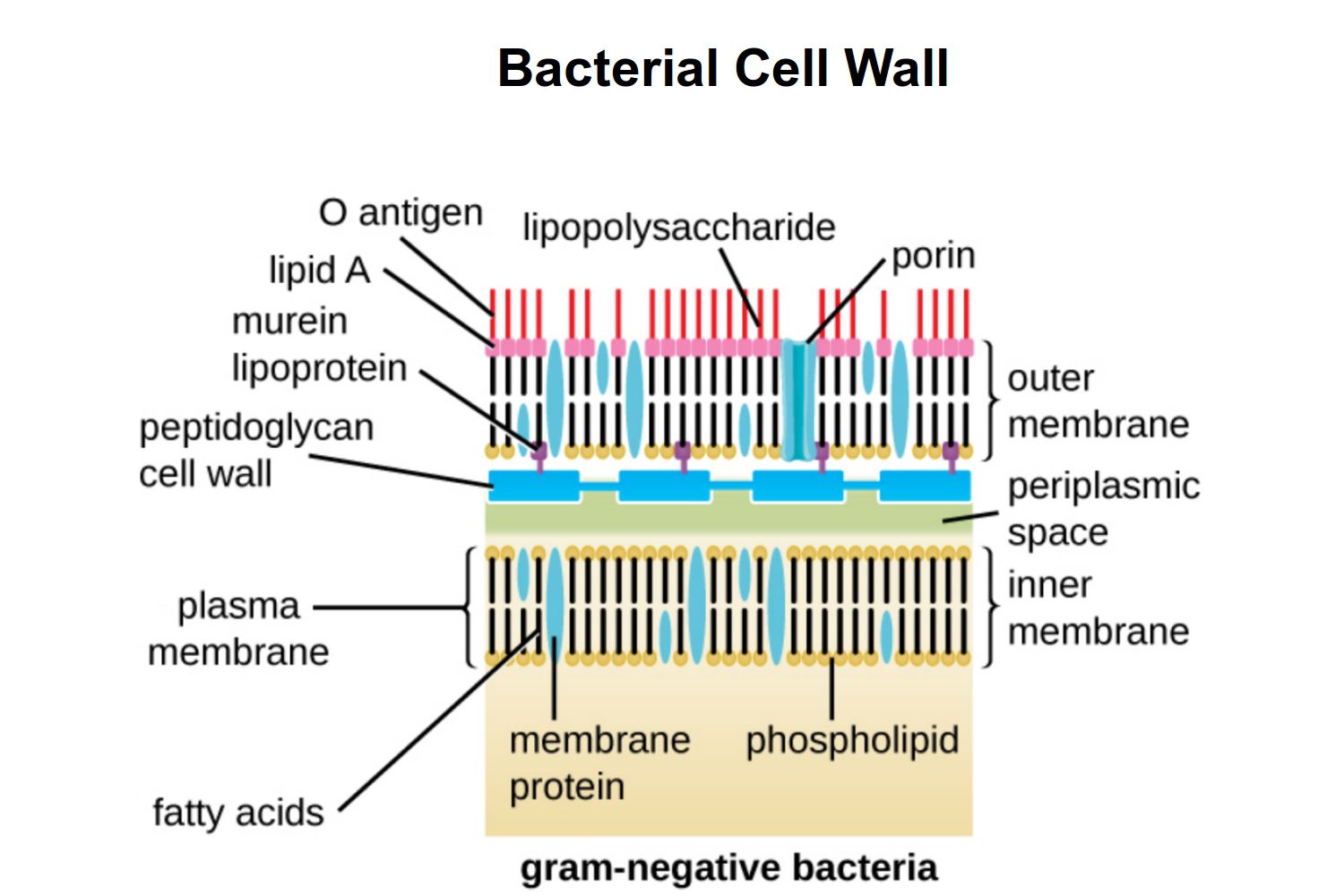
Внешняя мембрана (ВМ) является определяющей характеристикой грамотрицательных бактерий, она служит барьером проницаемости и обеспечивает ригидность клетки. "Понимание того, как бактерии создают этот барьер, является важным шагом в стратегиях его обхода", - говорит Томас Сильхави, старший автор двух новых работ, посвященных исследованию внешней мембраны: одной - в Proceedings of National Academy Sciences и другой - в Trends in Microbiology.
Важнейшей для ВМ функцией является создание и поддержание асимметричной двухслойной структуры с фосфолипидами во внутреннем слое и сложными гликолипидными липополисахаридами (ЛПС) во внешнем слое. Клетки обеспечивают эту асимметрию, регулируя биогенез липида A - необходимого якоря ЛПС.
ЛПС увеличивают механическую прочность оболочки и наружной мембраны грамотрицательных бактерий и предотвращают проникновение в клетку токсичных молекул, в том числе некоторых антибиотиков. При высвобождении из бактериальной наружной мембраны или выделении клеткой ЛПС становиться сильнодействующим токсином, способным вызывать тяжелые заболевания.
Грамотрицательные бактерии точно регулируют уровень ЛПС, так как дисбаланс является смертельным: слишком большое количество ЛПС нарушает целостность внутренней мембраны, в то время как слишком малое количество ослабляет ВМ.
"Количество ЛПС, производимое клеткой, тщательно контролируется, так как слишком малое количество ЛПС может привести к разрыву клетки, в то время как слишком большое их количество, особенно будучи не собрано должным образом, является токсичным", - говорит Рэнди Гост, ведущий автор статьи в Trends. "Мы проанализировали исследования трех основных мембранных белков, которые контролируют не только биосинтез ЛПС внутри клетки, но и его транспортировку и правильную сборку на поверхности клетки".
Строительство бактериальной наружной мембраны представляет собой сложную проблему для бактерий, потому что потенциально опасные ЛПС, сделанные внутри клетки, должны быть перенесены через клеточную стенку, чтобы добраться до наружной мембраны. Кроме того, эти процессы должны быть сбалансированы с производством и транспортировкой других компонентов мембраны, которые у грамотрицательных бактериях в основном представлены фосфолипидами.
"Одна из давних загадок в этой области заключается в том, как фосфолипиды транспортируются к внешней мембране", - рассказывает Сильхави.
Одна из гипотез заключается в том, что фосфолипиды могут пассивно перемещаться туда и обратно между внутренней и наружной клеточной мембраной бактерии в зонах их контакта, но эта идея считается весьма спорной. Новые исследования, проведенные группой Сильхави, подтверждают гипотезу о том, что пассивный вид транспорта действительно существует.
Для исследований трафика фосфолипидов между внутренней и наружной мембранами ученые использовали бактерий с мутацией, которая увеличивает скорость потока фосфолипидов от внутренней мембраны к наружной. Будучи лишены питательных веществ, эти бактерии испытывают сжатие и разрыв внутренней мембраны с последующей гибелью клетки, потому что они не в состоянии сделать новые фосфолипиды для внутренней мембраны, чтобы заменить те, которые были потеряны в наружной мембране. Авторы произвели дополнительные мутации в этих бактериях и обнаружили гены, которые при мутации влияют на то, как быстро бактерии погибают после лишения их питательных веществ.
"Мы использовали секвенирование следующего поколения для скрининга генов, вовлеченных в этот процесс, и обнаружили, что сбой работы гена YhdP замедляет транспорт фосфолипидов", - рассказал Сильхави.
Хотя их данные показывают, что белок, кодируемый yhdP, участвует в транспорте фосфолипидов между внутренней и наружной мембраной клетки, ученые отметили, что пока не ясно, как белок YhdP влияет на этот процесс. Потенциальная подсказка может быть найдена в его предполагаемом сходстве с другими белками, функция которых уже известна. Одним из них является белок, образующий канал, по которому фосфолипиды транспортируются через мембраны.
"Это говорит о том, что YhdP может образовывать гидрофобный канал между внутренней и внешней мембраной, по которому движутся фосфолипиды", - отметил Сильхави.
"Сильхави и его коллеги на сегодняшний день предоставляют самые достоверные данные для определения того, как фосфолипиды перемещаются между мембранами в бактериях, что являлось трудноразрешимым вопросом на протяжении десятилетий в нашей области", - отметил М. Стивен Трент, профессор инфекционных болезней Университета Джорджии. "Базируясь на генетических и биофизических данных, они приводят сильный аргумент в пользу того, что белок YhdP с ранее не известной функцией воздействует на быстрый процесс переноса фосфолипидов между мембранами. Будет действительно интересно больше узнать о роли YhdP в транспорте фосфолипидов".
Изучение этих процессов дает важное представление о физиологии бактерий и потенциальных новых мишенях для антибиотиков, способных преодолеть быстро развивающиеся механизмы резистентности.