Представьте, что вы пытаетесь освоиться в новом доме и при этом постоянно подвергаетесь нападениям. Именно с этим сталкивается бактерия Pseudomonas aeruginosa, когда инфицирует легкие.
Она не может одновременно и распространяться и защищаться от антибиотиков, тем не менее она является одним из главных виновников внутрибольничных инфекций и печально известна тем, что вызывает длительные инфекции, резистентные к антибиотикам, особенно у людей с заболеваниями легких, такими как муковисцидоз, ХОБЛ или бронхоэктазы.
Чтобы выжить в сложных условиях, P. aeruginosa образует биопленки, но за биопленки приходится платить: сгруппированные бактерии теряют способность передвигаться, находить питательные вещества и эффективно распространяться. Для P. aeruginosa, инфицирующей легкие, это представляет собой дилемму: должна ли она распространиться или затаиться, чтобы противостоять воздействию антибиотиков? Достижение правильного баланса может означать жизнь и смерть для патогена, а его нарушение - жизнь и смерть для пациентов.
Новое исследование ученых Швейцарского Института глобального здравоохранения, опубликованное в журнале Nature Microbiology, позволило выяснить, как P. aeruginosa преодолевает компромисс между колонизацией и выживанием во время инфекции, переключаясь между формированием биопленки для защиты от антибиотиков и более подвижным, «планктонным» состоянием для распространения и доступа к питательным веществам в зависимости от давления окружающей среды.
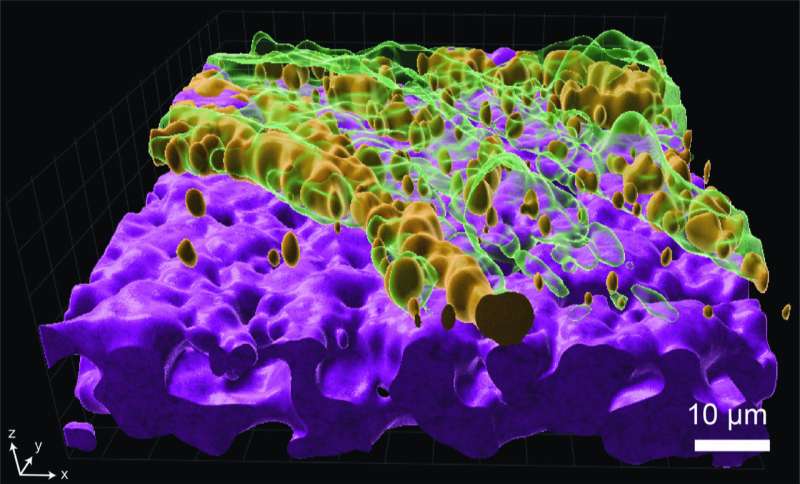
Чтобы лучше понять поведение P. aeruginosa, исследователи выращивали бактерии в тканевых моделях (органоидах), имитирующих человеческие легкие. «Затем мы использовали высокопроизводительный метод скрининга, называемый секвенированием транспозонов-вставок (Tn-seq), в сочетании с метаболическим моделированием и живой визуализацией, чтобы изучить, как P. aeruginosa адаптируется к колонизации слизистой поверхности легких и переносит воздействие антибиотиков», - рассказал Лукас Мейреллес, руководитель исследования.
Благодаря методу Tn-seq ученые определили, какие гены важны для выживания бактерии в разных условиях: те, которые способствуют выживанию во время колонизации слизистой, и те, которые помогают бактерии перенести воздействие антибиотиков. Авторы также использовали вычислительное моделирование, чтобы воспроизвести, как бактерии метаболизируют питательные вещества в легочной среде, что помогло точно определить метаболические механизмы, которые P. aeruginosa использует во время инфекции.
Живая визуализация в сконструированных органоидах показала, что обитающие в биопленке клетки остаются неподвижными при колонизации поверхности слизистой оболочки, что ограничивает поиск питательных веществ и снижает рост. Напротив, образование биопленки повышало толерантность к антибиотикам на поверхности слизистой оболочки. Более того, мутанты с усиленным фенотипом биопленки защищали менее толерантные, но более цитотоксичные штаммы, способствуя фенотипической гетерогенности.
Таким образом, P. aeruginosa должна постоянно преодолевать противоречивое физическое и биологическое селективное давление для поддержания хронической инфекции.