Респираторные заболевания, такие как обструктивное апноэ сна (ОАС), астма и хроническая обструктивная болезнь легких (ХОБЛ), продолжают вносить свой вклад в глобальную заболеваемость и смертность во всем мире.
В статье, недавно опубликованной в журнале MDPI Microorganisms, исследователи рассматривают роль микробиома кишечника в этих респираторных заболеваниях и то, как модуляция этих видов бактерий в организме может обеспечить терапевтические преимущества для смягчения этих состояний.
Предыдущие исследования показали, что такие респираторные заболевания, как ОАС, астма и ХОБЛ, вероятно, возникают из-за сложных взаимодействий между генетическими и экологическими факторами. Эти же факторы часто влияют на состав микробиома кишечника, поэтому важно понять, как микробиом кишечника способствует развитию хронических респираторных заболеваний.
Хотя кишечник и легкие анатомически различны, они имеют микробиоту, которая может способствовать их коммуникации. Многочисленные факторы способствуют изменению микробиома кишечника и аналогичным образом оказывают негативное влияние на развитие заболеваний легких. Например, некоторые диетические вмешательства могут влиять на микробиом дыхательных путей и, как следствие, на иммунитет в этой системе органов. Бессонница, связанная с ОАС, также может влиять на микробиом кишечника, повышая аппетит.
Табакокурение, наиболее распространенный фактор риска ХОБЛ, также может изменять микробиом кишечника. Например, у активных курильщиков более многочисленны Bacteroidetes, а Firmicutes менее распространены. Воздействие загрязнения воздуха, в основном мелкодисперсных твердых частиц, оксида азота, оксида серы, озона и тяжелых металлов, может ухудшить течение ХОБЛ и способствовать ее развитию. Подобным образом воздействие некоторых химических веществ окружающей среды может негативно влиять на микробиом кишечника, что в конечном итоге приводит к дисбактериозу. Например, воздействие оксида азота было связано с уменьшением количества Clostridium leptum и Faecalibacterium prausnitzii, а также с увеличением количества Escherichia coli, Enterococcus faecalis и Proteus mirabilis. Было показано, что такие препараты, как глюкокортикоиды и антибиотики, обычно используемые для лечения респираторных заболеваний, также провоцируют дисбактериоз.
Микробиом кишечника может поддерживать иммунные реакции, напрямую взаимодействуя с иммунными клетками. И наоборот, системная циркуляция специфических бактериальных метаболитов, таких как липополисахариды (LPS) и короткоцепочечные жирные кислоты (КЦЖК), может привести к воспалению, усугубляя существующие воспалительные заболевания дыхательных путей.
Астма, которой страдают более 300 миллионов человек во всем мире, характеризуется широким спектром симптомов, обусловленных в первую очередь хроническим гипервоспалением дыхательных путей. Предыдущие исследования, основанные на гигиенической гипотезе, которая гласит, что снижение уровня инфекций в развитых странах мира сопровождалось ростом аллергических и аутоиммунных заболеваний, указывают на причастность микробиома кишечника к развитию атопической астмы.
В одном исследовании ученые обнаружили, что у новорожденных с атопией и хрипами в течение первых 100 дней жизни снижен уровень Faecalibacterium, Veillonella, Lachnospira и Rothia, а также снижен уровень КЦЖК. Другое исследование, проведенное на годовалых детях, показало, что обилие Veillonella прямо коррелирует с развитием астмы в возрасте пяти лет; однако это было верно только для детей, рожденных от матерей-астматиков. В совокупности эти данные свидетельствуют о том, что изменения в микробиоме кишечника в течение первого года жизни могут напрямую влиять на риск развития астмы у ребенка.
Хотя дисбиоз кишечника может способствовать развитию астмы, значительные различия в составе микробиома и проявлениях астмы ограничивают возможность сделать однозначные выводы о связи между этими двумя состояниями. Тем не менее, будущие исследования с применением стандартизированного анализа микробиома могут лучше понять роль кишечных бактерий в развитии астмы.
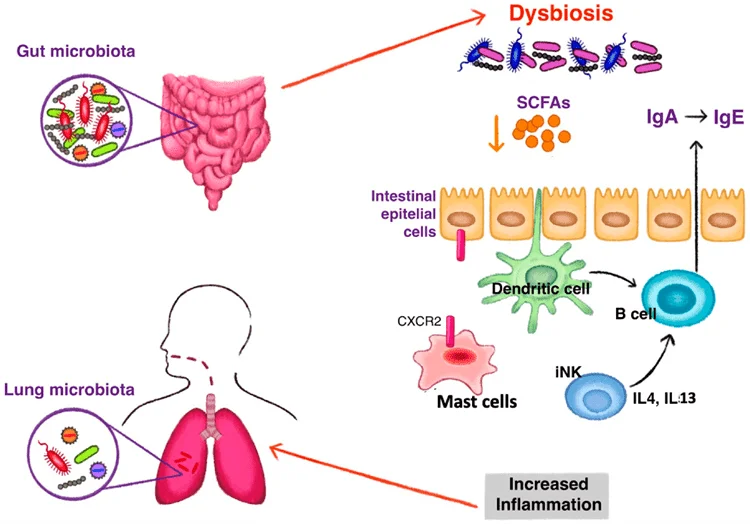
Механизм развития дисбиоза кишечника, приводящего к развитию воспаления 2-го типа при астме. Снижение уровня короткоцепочечных жирных кислот (КЦЖК) вызывает переключение классов иммуноглобулинов (Ig) с повышением уровня фекального IgE, действующего на дендритные клетки. Переключение на производство IgE также стимулируется высоким уровнем интерлейкинов (IL) 4 и IL 13, вырабатываемых инвариантными естественными клетками-киллерами (iNK) под воздействием дисбиоза. Дисбиоз влияет на хоминг тучных клеток в кишечнике посредством экспрессии CXCR2. Меньшее количество тучных клеток в кишечнике и повышенный уровень в крови стимулируют воспалительное состояние, наблюдаемое при астме.
ХОБЛ - это хроническое и прогрессирующее заболевание дыхательных путей, которое обычно поражает дыхательные пути, паренхиму легких и сосудистую систему. Некоторые факторы, непосредственно связанные с развитием ХОБЛ, включая воздействие вредных химических веществ и курение в анамнезе, могут непосредственно влиять на состав микробиома кишечника у этих пациентов.
По-прежнему не хватает крупномасштабных исследований, изучающих связь между ХОБЛ и микробиомом кишечника, что ограничивает возможности исследователей понять, как дисбиоз кишечника может влиять на прогрессирование ХОБЛ. Тем не менее, одно исследование, включавшее 28 пациентов с ХОБЛ, выявило повышенное содержание Streptococcus, Rothia, Intestinibacter и Romboutsia у пациентов с ХОБЛ и пониженный уровень Bacteroides, Lachnospira и Roseburia по сравнению с контролем. Количество стрептококков и Lachnospiraceae у этих пациентов с ХОБЛ было обратно пропорционально функции легких. В другом исследовании повышенное количество Acinetobacter и Stenotrophomonas было связано со снижением функции легких у пациентов с ХОБЛ.
ОАС - это распространенное расстройство, характеризующееся постоянным коллапсом верхних дыхательных путей во время сна, что приводит к изменению режима сна и частым периодам гипоксемии. Негативные последствия ОАС повышают риск развития у пациента различных сердечно-сосудистых, метаболических и неврологических заболеваний.
На сегодняшний день изучению взаимосвязи между ОАС и микробиомом кишечника посвящено ограниченное количество исследований. В одном исследовании, проведенном на двухлетних детях, соотношение Firmicutes/Bacteroides было выше, а микробное разнообразие было ниже у храпящих детей по сравнению с нехрапящими. Аналогичным образом, низкое микробное разнообразие наблюдалось в когорте детей в возрасте от двух до 12 лет с ОАС, в дополнение к более высокому обилию Proteobacteria у этих пациентов.
В ряде исследований изучалось, как пробиотики, пребиотики, различные диеты и трансплантация фекальной микробиоты (FMT), модулирующие микробиоту кишечника, могут быть использованы для улучшения течения некоторых респираторных заболеваний.
В нескольких исследованиях на мышах оценивалось, как включение определенных диетических компонентов может повлиять на иммунные реакции в легких. Например, диета с высоким содержанием клетчатки, повышающая уровень циркулирующих КЦЖК, защищала мышей от аллергических заболеваний дыхательных путей, а инокуляция Lactobacillus johnsonii в кишечник мышей снижала их Th2-ответ в легких. Кроме того, добавки с Bifidobacterium lactis BB-12, докозагексоновой кислотой, а также витаминами С и Е эффективно снижали воспаление легких у мышей, ранее подвергавшихся загрязнению воздуха. Прием пробиотиков Lactobacillus rhamnosus и Bifidobacterium breve у мышей также уменьшил воспаление дыхательных путей и повреждение альвеол.
Эффекты различных пероральных добавок также были оценены в многочисленных испытаниях на людях. Например, добавка Bifidobacterium longum BB536 у детей в возрасте от двух до шести лет эффективно сокращала продолжительность распространенных инфекций верхних дыхательных путей в этой популяции. Аналогичным образом, добавка Lactobacillus plantarum DR7 в течение 12 недель значительно снижала назальные симптомы, частоту ОРВИ, а также плазменные уровни различных провоспалительных маркеров, включая интерферон-γ (IFN-γ) и фактор некроза опухоли-α (TNF-α).
Исследователи также предложили FMT в качестве нового подхода к восстановлению микрофлоры кишечника у пациентов с некоторыми респираторными заболеваниями. В экспериментальных исследованиях у мышей, подвергшихся FMT и впоследствии получавших диету с высоким содержанием клетчатки, наблюдалось увеличение количества Bacteroidaceae и Lachnospiraceae, что сопровождалось снижением вероятности возникновения у мышей тяжелых симптомов, связанных с ХОБЛ.
В другом исследовании, оценивающем влияние FMT на LPS-индуцированное повреждение легких, наблюдалось снижение уровня TLR4/NK-kB сигнализации, а также уменьшение воспаления и окислительного стресса в легких животных с острым повреждением легких. Аналогичные результаты наблюдались и в другом исследовании, где FMT улучшила реакцию безмикробных мышей после бактериальной инфекции. Несмотря на эти наблюдения, необходимо провести дополнительную работу, чтобы определить безопасность FMT и преимущества, связанные с этим методом лечения респираторных заболеваний.