Широкий спектр применений, в которых бактерии и вирусы используются для терапии, отражает разнообразие самих микробов.
Различные бактерии могут быть нацелены на различные ткани, микробиомы и даже внутри- и внеклеточные пространства. От Staphylococcus epidermidis, колонизирующего кожу, до Mycoplasma pneumoniae, проникающей в легкие, до внутриклеточно растущих Listeria monocytogenes и Salmonella typhimurium - каждая из этих бактерий обладает уникальными возможностями, которые можно использовать для создания синтетических продуктов.
Аналогичным образом, спектр семейств вирусов, исследуемых для применения в терапии, столь же широк, и в приложениях используются различные структуры генома, природные тропизмы и жизненные циклы каждого из них. Примеры включают небольшие ДНК-вирусы, такие как аденоассоциированный вирус, для неиммуногенного воздействия на ткани, вирусы с отрицательной цепью РНК, такие как вирус бешенства, для ретроградного отслеживания нейронов и вирусы с положительной цепью РНК, такие как производное полиовируса "PVSRIPO", для онколитических целей. Таким образом, микробы с совершенно различными клеточными особенностями нашли применение в своей конкретной нише.
В подходах к лечению бактерии и вирусы, как правило, рассматриваются отдельно. Тем не менее, при естественном сопутствующем инфицировании некоторые вирусы и бактерии непосредственно связываются друг с другом, что может привести к повышению эффективности. Аналогичным образом, приложения в синтетической биологии начинают обеспечивать координацию между множеством взаимодействующих объектов с уникальными свойствами, которые в совокупности могут создавать консорциум, достигающий общей цели.
В этой работе мы рассматриваем синтетические подходы к взаимодействию вирусов и бактерий для преодоления ключевых проблем, связанных с применением микробиологической терапии для борьбы с раком. В то время как онколитические вирусы показали эффективность в клинических испытаниях, ранее существовавший гуморальный иммунитет может ограничивать способность вирусных частиц, доставляемых системным путем, достигать опухолей-мишеней. Между тем, разработанные бактериальные методы лечения могут доставлять генетическую нагрузку в опухолевые клетки, но, как правило, остаются локализованными в ядре опухоли и ограничены в своей способности воздействовать на периферические или отдаленные опухолевые клетки. Действительно, клинические испытания с использованием таких штаммов, как аттенуированная сальмонелла VNP200009, еще не продемонстрировали значительной клинической эффективности и дозозависимой токсичности.
В данной работе мы устраняем эти ограничения, разрабатывая платформу под названием CAPPSID (Coordinated Activity of Prokaryote and Picornavirus for Safe Intracellular Delivery - скоординированная активность прокариот и пикорнавирусов для безопасной внутриклеточной доставки). Эта система состоит из синтетического взаимодействия бактерий и вирусов для системной доставки онколитического пикорнавируса в опухоли, где бактерии могут скрывать вирус от циркулирующих противовирусных антител. Затем, попав внутрь опухоли, бактерии могут запустить вирус и распространиться.
В частности, CAPPSID основанный на биоинженерных S. typhimurium действует как динамичный и синтетический "капсид" для транскрибирования и доставки вирусной РНК внутрь раковых клеток, запуская вирус, который может непосредственно лизировать окружающие клетки. Мы модифицировали вирус таким образом, чтобы ему требовался дополнительный фермент, полученный от бактерий, необходимый для созревания вируса и последующего распространения, тем самым ограничивая репликацию вируса одним дополнительным циклом заражения за пределами исходной бактериосодержащей клетки (рис. 1).
В совокупности такое взаимодействие бактерий и вирусов обеспечивает ингибирование опухоли и пролонгированную репликацию сконструированного вируса. Таким образом, это первый пример прямого сконструированного сотрудничества между бактериями и онколитическими вирусами, и эта работа демонстрирует созданные на заказ взаимодействующие сообщества программируемых лекарственных средств.
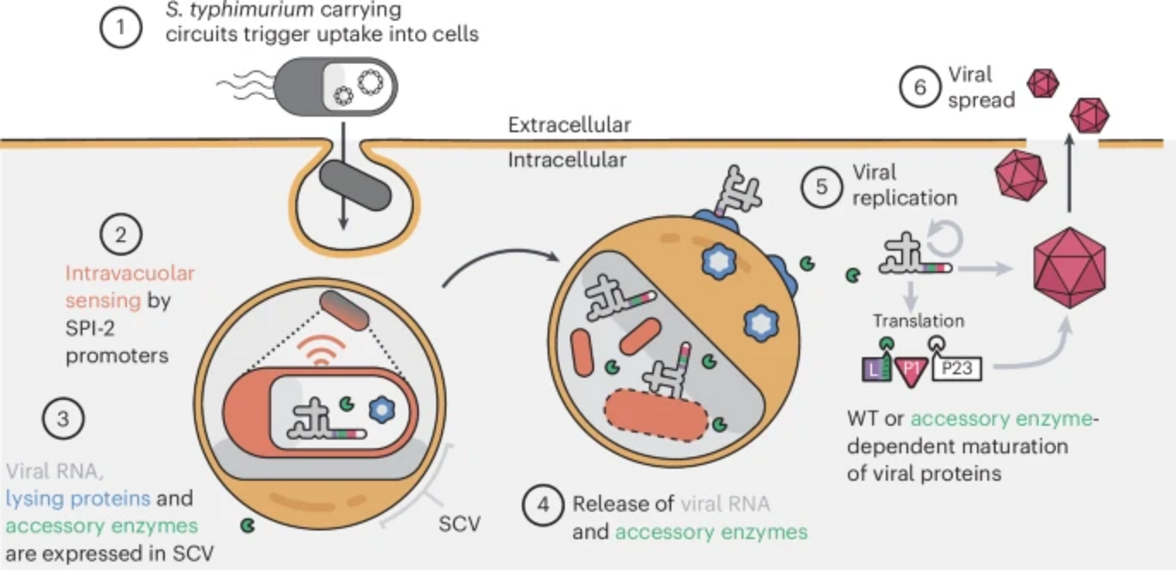
Рис. 1. Запрограммированный S. typhimurium автономно лизируется в цитоплазме хозяина, запуская вирусную РНК и необходимую ортогональную вирусную протеазу.
(1) S. typhimurium, несущий синтетические цепи, проникает в клетки млекопитающих через естественные эффекторы, закодированные на острове патогенности сальмонеллы 1 (SPI-1).
(2) Интернализованный S. typhimurium в вакуоле, содержащей сальмонеллу (SCV), распознает внутривакуолярное пространство и запускает активацию промоторов SPI-2.
(3) Модифицированные промоторы SPI-2 затем используются для стимулирования производства вирусных РНК (репликона полиовируса, сенекавируса A (SVA) или сконструированного SVA-вируса А), лизирующих белки гемолизина E (HlyE) и E из фага φX174 и вспомогательного фермента.
(4) После успешного бактериального и вакуолярного лизиса вирусные РНК и вспомогательный фермент высвобождаются в цитоплазму хозяина.
(5) Вирусные РНК дикого типа (WT) транслируются в цитоплазму и инициируют репликацию вируса. Процесс созревания вирусных частиц может быть сконструирован таким образом, что для его полного созревания требуется дополнительный фермент.
(6) Инфекционные частицы попадают во внеклеточное пространство и инфицируют соседние клетки. Поскольку бактерии S. typhimurium действуют как вирусный "капсид", мы назвали платформу скоординированной активности прокариот и пикорнавирусов для безопасной внутриклеточной доставки (CAPPSID).
Разрабатывая бактериально доставляемую платформу для вирусной РНК, мы демонстрируем успешный запуск вирусной инфекции, способной уничтожать опухоли, маскировать и доставлять вирусные геномы в мышиной модели опухоли у мышей с гуморальным иммунитетом, а также то, что распространение вируса, контролируемое с помощью бактериально переданной протеазы, может повысить эффективность по сравнению с использованием только репликона. Вместе этот созданный микробиологический консорциум создает эффективную терапию, которая преодолевает ограничения отдельных подходов.
Эта работа распространяет бактериальную терапию на вирусные геномы и показывает, как консорциум вирусов и бактерий может достичь совместной цели.