Многие антибиотики ингибируют рост бактерий, связываясь с рибосомой и мешая биосинтезу белков.
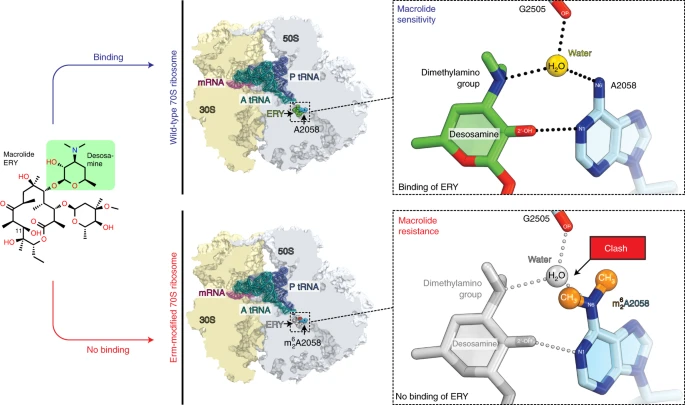
Макролиды представляют собой один из наиболее успешных классов рибосом-таргетных антибиотиков. Основным клинически значимым механизмом устойчивости к макролидам является диметилирование нуклеотида А2058 в 23S рРНК, расположенного в месте связывания препарата, реакция, катализируемая Erm-типом рРНК метилтрансфераз.
Здесь мы представляем кристаллическую структуру Erm-диметилированной рибосомы 70S с разрешением 2.4Å, а также структуры неметилированных рибосомальных функциональных комплексов 70S по отдельности или в комбинации с макролидами. В целом, наши структурные данные не поддерживают предыдущие модели и, вместо этого, предлагают принципиально новое объяснение того, как диметилирование A2058 опосредует сопротивление макролидам.
Структуры, исследованные в высоком разрешении, двух антибиотиков-макролидов, связанных с немодифицированной рибосомой, выявляют ранее неизвестную роль водной формы дезозамина в связывании препаратов. Молекула воды, необходимая для герметичного связывания антибиотиков, отсутствует в рибосомах лекарственно-резистентных возбудителей.
Это закладывает основу для рационального конструировании макролидов, способном преодолеть Erm-опосредованную резистентность.