Надежные механизмы распознавания и уничтожения микробных патогенов необходимы для поддержания целостности организмов млекопитающих.
Врожденная и адаптивная иммунные системы взаимодействуют между собой, формируя быстрые реакции для уничтожения внеклеточных патогенов. Однако многие клинически значимые микроорганизмы разработали стратегии выживания и репликации внутри клеток хозяина. В ответ на это клетки млекопитающих развили молекулярные механизмы, которые вызывают эффекторные механизмы защиты от внутриклеточных микробов на уровне отдельных клеток. Эти механизмы включают уничтожение патогенов путем аутофагии, активации эффекторного иммунитета цитокинами интерферона (IFN) и активации комплексов инфламмасомы. Чтобы подорвать цитозольный контроль, некоторые внутриклеточные патогены кооптируют эндомембранную систему клетки-хозяина и помещают себя в вакуоли. Другие патогены нарушают этот процесс, чтобы реплицироваться в цитозоле. В обоих случаях клеточный иммунитет выступает в качестве последней линии защиты от таких патогенов.
Одна из мощных эффекторных систем клеточного автономного иммунитета высвобождает цитокины IFN I и II типов, вызывая экспрессию IFN-стимулированных генов. Среди наиболее сильно индуцируемых генов - консервативное суперсемейство динаминоподобных гуанозинтрифосфатаз (ГТФаз), включая семейство гуанилат-связывающих белков (GBPs). В последнее десятилетие GBPs были признаны ключевыми игроками в обеспечении защиты хозяина от внутриклеточных бактерий, паразитов и вирусов путем формирования сенсорных платформ, влияния на целостность вакуолей или непосредственного взаимодействия с мембраной цитозольных грамотрицательных бактерий и паразитов.
Геном человека кодирует семь паралогов GBP, имеющих сходство с другими членами суперсемейства динаминоподобных ГТФаз, которые подвергаются гуанин-нуклеотид-зависимой олигомеризации и опосредуют слияние или деление мембран в различных биологических процессах. GBPs обладают высокой внутренней ГТФазной активностью для гидролиза гуанозин-5′-трифосфата (ГТФ) до гуанозин-5′-дифосфата (ГДФ) без участия вспомогательных белков-активаторов ГТФазы или факторов обмена гуаниновых нуклеотидов.
Энзимология GBPs уникальна среди суперсемейства динаминов тем, что некоторые GBPs могут также связывать GDP с высоким сродством для получения гуанозин-5′-монофосфата (GMP), который может влиять на рост бактерий и воспалительную сигнализацию. В отсутствие инфекции GBP локализуются в цитозоле или редко ассоциируются с эндогенными мембранами. При индукции IFN GBPs быстро собираются в надмолекулярные мембранно-ассоциированные оболочки на патогенсодержащих вакуолях и инкапсулируют цитозольные грамотрицательные бактерии.
Присоединение других эффекторов и высвобождение липополисахарида (ЛПС), гликозилированного липидного компонента внешней мембраны грамотрицательных бактерий, активирует неканонический инфламмасомный путь, приводящий к каспазному 4-зависимому расщеплению газдермина D и пироптозу. Привлечение GBP к мембранам зависит от посттрансляционных модификаций мотива изопренилирования CaaX. Три человеческих GBP содержат мотивы CaaX, которые приводят к ковалентному присоединению 20-углеродного геранилгеранильного (GBP2 и GBP5) или 15-углеродного фарнезильного (GBP1) мотивов, опосредующих мембранную ассоциацию in vivo.
В свободном от нуклеотидов состоянии фарнезиловый мотив GBP1 находится в гидрофобном кармане и для его высвобождения требуется связывание нуклеотида. Последующие конформационные изменения способствуют взаимодействию с липидными мембранами или самоолигомеризации в мицеллярные структуры в отсутствие липидов. Все известные антимикробные функции GBPs в значительной степени зависят от изопренилирования GBP1, что делает понимание конформационных изменений, которые способствуют физическому взаимодействию с мембранами, важным для понимания их роли в цитозольной защите хозяина. В отсутствие структурных данных высокого разрешения о полноразмерном GBP1 в активированном состоянии и о нативных структурах мембраноассоциированных агрегатов GBP важные вопросы, связанные с их способом действия, остаются неясными.
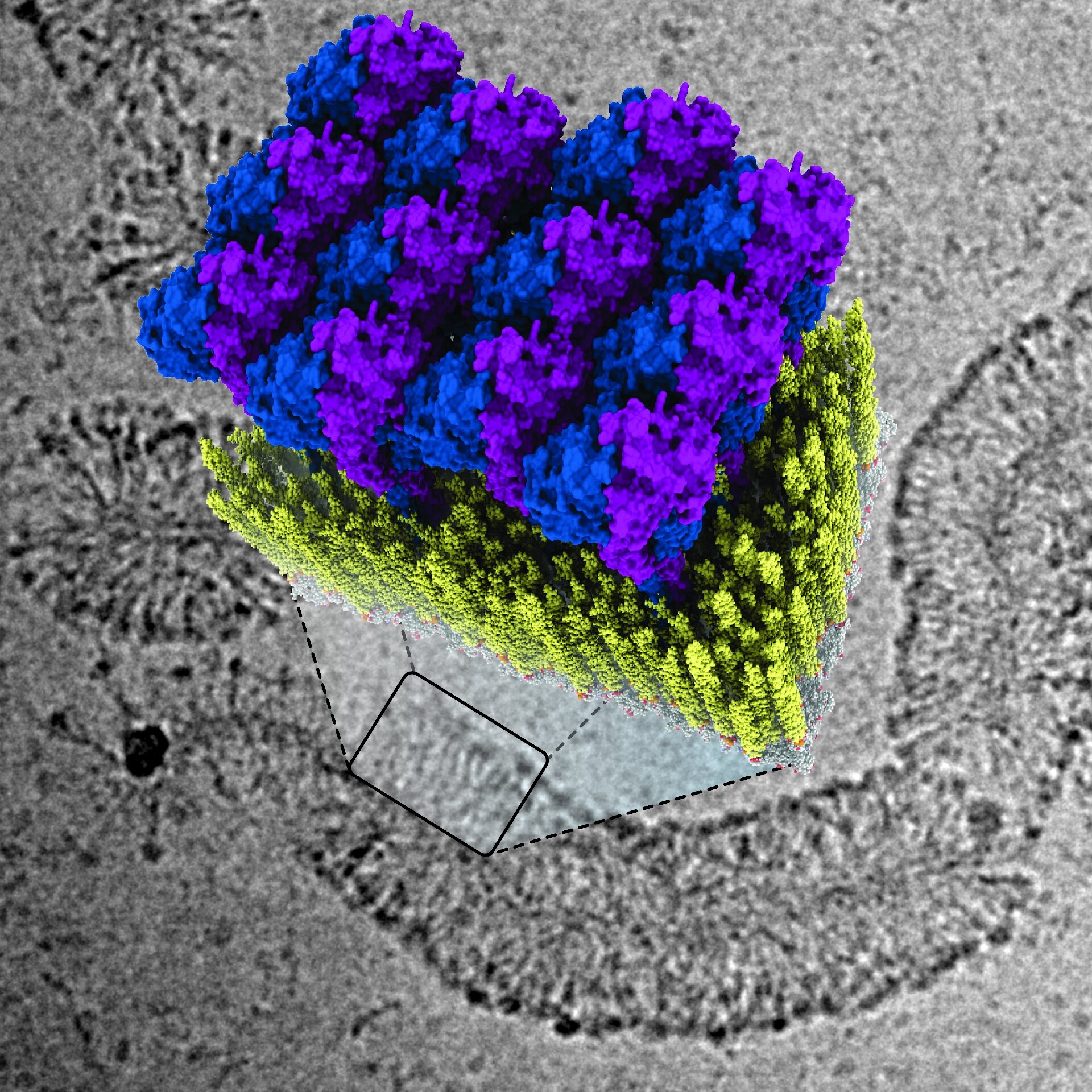
В данном исследовании мы определили с помощью криоэлектронной микроскопии структуру полноразмерного нуклеотид-связанного димера человеческого GBP1, которая выявила крупномасштабные конформационные изменения α-спирального среднего и эффекторного доменов ГТФазы, стабилизирующие вытянутую конформацию, подходящую для мембранной ассоциации. Биохимический анализ in vitro и электронная томография мембранной сборки GBP1 указывают на критическую роль этой конформации в формировании оболочки GBP на эндогенных и бактериальных мембранах. Важно отметить, что собранные на мембране олигомеры GBP1 обладают способностью к ГТФаз-зависимому мембранному ремоделированию, что может объяснить наблюдения, в которых сообщается о ГТФ-зависимой модуляции целостности мембраны и высвобождения ЛПС. Наши данные создают структурную основу для дальнейших исследований, направленных на раскрытие молекулярного механизма антимикробной и противовирусной активности GBP.