С тех пор, как более двух столетий назад была изобретена первая вакцина, появились новые открытия, обеспечивающие более эффективную защиту.
В конце 1700-х годов Эдвард Дженнер, английский врач и ученый, заметил, что доярки, которые ранее болели коровьей оспой, имеют иммунитет к натуральной оспе, смертельному вирусу из того же семейства. Из любопытства, действительно ли воздействие коровьей оспы и невосприимчивость к натуральной оспе связаны, Дженнер провел первое “клиническое испытание” вакцины в 1796 году, когда он привил восьмилетнему Джеймсу Фиппсу гной от коровьей оспы. К счастью для всех участников, Фиппс стал невосприимчив к оспе. Позднее Дженнер придумал слово "вакцина" в честь латинского слова vacca, что означает "корова", а затем опубликовал свои результаты в 1798 году. Спустя почти два столетия после открытия Дженнера оспа была ликвидирована. Со времени проведения первого эксперимента Дженнера и до недавней пандемии COVID-19 вакцины позволили решить ряд проблем общественного здравоохранения. В этой статье рассказывается о некоторых последних достижениях в области исследований вакцин.
Более чем через столетие после открытия Дженнера французский ветеринар Гастон Рамон заметил, что у лошадей, иммунизированных против дифтерии, развивается более сильная иммунная реакция, если они также испытывают воспалительную реакцию в месте инъекции. Он показал, что добавление различных веществ в вакцины может заставить организм думать, что он подвергается инфекции, и, как следствие, усилить иммунные реакции. Сегодня в качестве добавок к вакцинам используется широкий спектр веществ, от алюминия до коры чилийского дерева — они широко известны как адъюванты.
Один из самых мощных вакцинных адъювантов, QS-21, традиционно получают из коры чилийского дерева Quillaja saponaria. Но, чтобы удовлетворить растущий спрос, ученые пытались получить QS-21 в лабораторных условиях. В недавнем исследовании Джей Кислинг, биоинженер из Калифорнийского университета, и его коллеги выяснили, как синтезировать эту молекулу в дрожжах, используя простой сахар. Исследователям удалось вырастить QS-21 за считанные дни, что резко контрастирует с 30-50 годами, которые обычно требуются дереву.

Ученые разработали дрожжи для получения QS-21, мощного адъюванта к вакцине, в 1000 раз быстрее, чем это может сделать дерево, из которого его добывают естественным путем. Фото: John A Horsfall.
Сочетание нескольких вакцин может означать меньшее количество визитов к врачу, меньшее количество прививок детям и более счастливых родителей. Но прежде чем ученые объединят несколько вакцин в одну, такую как вакцина от дифтерии, коклюша и столбняка (АКДС), они должны будут тщательно оценить, будут ли эти вакцины хорошо работать вместе. Ключевым фактором, который они должны учитывать, является желаемый эффект от каждой вакцины. Например, исследователи обнаружили, что вакцины против COVID-19 на основе мРНК и вакцины против гриппа на основе белков могут улучшать способность друг друга вызывать иммунный ответ. С другой стороны, поскольку цитокины блокируют репликацию вируса, вакцины, стимулирующие выработку цитокинов, такие как противостолбнячная вакцина, могут мешать тем, которые зависят от доставки вируса.
Конъюгированные вакцины обычно используются для защиты людей с ослабленным иммунитетом, таких как маленькие дети и пожилые люди, от опасных для жизни бактериальных инфекций, таких как менингит и пневмония. При таком подходе полисахариды из мембраны болезнетворных бактерий химически связываются с белками-переносчиками. Это позволило добиться гораздо более сильного иммунного ответа по сравнению с тем, который может быть достигнут при самостоятельном введении бактериальных полисахаридов, которые являются слабыми антигенами. Теперь исследователи знают, что, активируя как В-, так и Т-клетки, конъюгированные вакцины могут продуцировать долгоживущие В-клетки, продуцирующие антитела, В-клетки памяти и молекулы высокоаффинных антител. В настоящее время продолжаются исследования, направленные на оптимизацию выбора белков-носителей и расширение масштабов производства конъюгированных вакцин для удовлетворения глобальных потребностей при меньших затратах.
Вакцины могут защитить людей от рака, опосредованного гепатитом В или вирусом папилломы человека, но на этом профилактические противораковые вакцины заканчиваются. Ученые не могут разработать вакцины для предотвращения спонтанного образования опухолей, потому что они не могут предсказать, какой онкогенный белок возникнет и на какой из них следует воздействовать. Однако противораковые вакцины могут быть использованы в терапевтических целях, так что полученные от пациента иммунные клетки подвергаются воздействию опухолевых антигенов, которые могут их активировать, и эти активированные иммунные клетки затем повторно вводятся пациентам. Некоторые ученые полагают, что при наличии правильных антигенов терапевтические противораковые вакцины могут обеспечить длительный иммунный ответ, который динамично адаптируется к развитию опухоли.
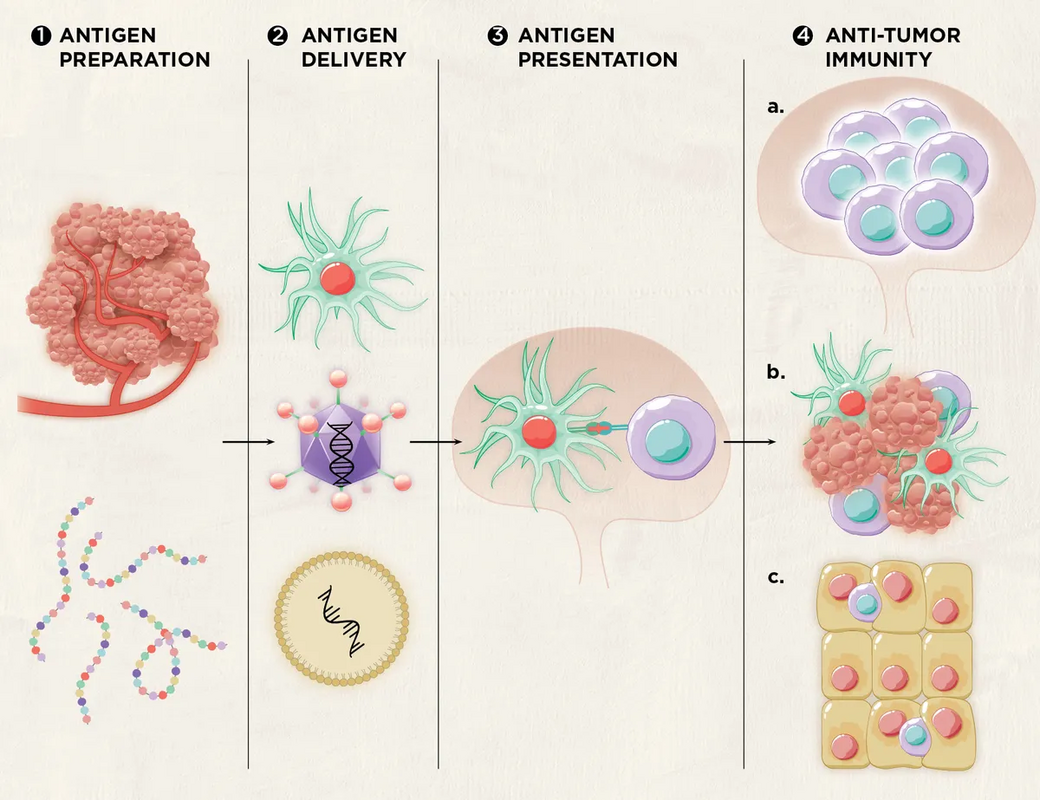
Иллюстрация: Rungnaree Jaitham, Shonyjade, PsychoBeard; designed by Ashleigh Campsall.
1. Получение антигена: ученые могут создавать противораковые вакцины против опухолей, используя опухоль пациента в качестве источника антигена или синтезируя пептиды из опухолевых антигенов.
2. Доставка антигенов: исследователи используют различные платформы для доставки антигенов: полученные от пациента дендритные клетки, аденоассоциированные вирусные векторы и липидные наночастицы.
3. Презентация антигена: после введения эти антигены в конечном итоге попадают в дендритные клетки пациента или немедленно экспрессируются на дендритных клетках, если они используются в качестве носителя. Дендритные клетки направляются в лимфатические узлы для активации антигенспецифических Т-клеток.
4. Противоопухолевый иммунитет: после активации эти специфичные к опухолевым антигенам Т-клетки мультиплицируются (а) и направляются к опухоли, где они помогают уничтожать опухолевые клетки (в). Некоторые активированные Т-клетки становятся клетками памяти (с, показаны фиолетовым цветом); они будут находиться в лимфатических узлах или близлежащих тканях, чтобы защитить организм от будущих рецидивов того же типа рака.
Разработка эффективных вакцин положила конец пандемии COVID-19. Однако среди вакцинированных людей по-прежнему происходят серьезные случаи заражения. Ученые полагают, что одной из причин этого является несоответствие между местом вакцинации - рукой - и местом воздействия возбудителя - носом. Чтобы восполнить этот пробел, Памела Вонг, иммунолог из Мичиганского университета, и ее коллеги разработали препарат для интраназального введения вакцины, который при использовании для доставки мышам белка спайка SARS-CoV-2 предотвращал инфицирование верхних дыхательных путей SARS-CoV-2 и обеспечивал лучшую перекрестную защиту от несколько штаммов вируса. Вонг предполагает, что интраназальная вакцинация будет использоваться в качестве стимулятора для привлечения иммунных клеток, которые ранее были получены в результате внутримышечной вакцинации, в носовую полость для предотвращения проникновения вируса и инфекции.
Врачи обычно назначают антибиотики новорожденным, у которых проявляются признаки инфекции или, что еще хуже, сепсиса, но это может дорого обойтись. Недавно Дэвид Линн, иммунолог из Южно-Австралийского института здравоохранения и медицинских исследований и коллеги обнаружили, что введение антибиотиков новорожденным может снизить их реакцию на определенные вакцины, а микробиом кишечника опосредует этот эффект. В своем исследовании ученые показали, что у младенцев, получавших антибиотики, было меньше бифидобактерий, распространенного вида бактерий в кишечном микробиоме, и это снижение коррелировало со снижением иммунных реакций на различные вакцины, такие как вакцина против столбняка. Чтобы напрямую продемонстрировать взаимосвязь между антибиотиками, реакцией на вакцину и микробиомом кишечника, исследователи обратились к мышам. Они показали, что добавление смеси пробиотиков или только бифидобактерий у мышей, не зараженных бактериями, восстанавливало их иммунный ответ на вакцины.

