Выявление в 2009 году в Восточной Азии нового грибка Candida auris и его быстрое распространение по всему миру стало напоминанием об угрозе, которую представляют грибковые патогены с множественной лекарственной резистентностью.
C. auris, вероятно, долгое время оставался нераспознанным, поскольку отсутствовали точные тесты. Лабораторное сообщество ответило на вызов C. auris публикацией 35 новых или пересмотренных методов диагностики в период с 2014 по начало 2021 года. Коммерческий сектор также внес изменения в существующие диагностические устройства. Эти диагностические тесты C. auris включают традиционные дифференциальные и селективные культуральные среды, биохимические ассимиляции и быстрые белковые профили, а также независимую от культуры диагностику на основе ДНК.
Мы представляем обзор этих разработок, особенно тестов с валидационными данными, которые впоследствии были одобрены для общего использования. Мы делимся рабочим процессом, разработанным в нашей лаборатории для обработки более 37 000 образцов C. auris, взятых для мониторинга, и 5000 изолятов C. auris, полученных во время вспышки в столичном регионе Нью-Йорка. В нашем обзоре представлены новые устройства и диагностические подходы, основанные на микрофлюидике, оптике и нанотехнологиях. Передовым лабораториям нужны быстрые, дешевые, стабильные и простые в применении тесты для улучшения диагностики C. auris, эпиднадзора, изоляции пациентов, скрининга при поступлении и контроля окружающей среды.
Среди неотложных потребностей - иммунохромотографические тесты или аналогичное тесты для предварительной идентификации C. auris. Всем лабораториям пригодятся устройства, позволяющие быстро проводить тестирование на восприимчивость к противогрибковым препаратам, включая выявление мутаций, вызывающих лекарственную устойчивость. Надеемся, что на горизонте появятся мультиплексные панели тестов для синергии тестирования на C. auris с текущим наблюдением за другими инфекциями, связанными с оказанием медицинской помощи. Анализ генома C. auris имеет доказанную роль в расследовании вспышек, и диагностическим лабораториям необходим быстрый доступ к региональным и национальным сетям геномного анализа.
Candida auris, новый патоген
Клинические лаборатории добились значительного прогресса в идентификации грибковых патогенов после внедрения секвенирования генов рибосомальной РНК и масс-спектрометрии с матричной лазерной десорбцией и ионизацией (MALDI-TOF MS). Эти подходы на основе ДНК и белков расширили возможности многих передовых лабораторий по распознаванию новых патогенов, которые ранее были уделом узкоспециализированных центров передового опыта.
Этот сценарий прекрасно реализовался, когда Candida auris была признана новым видом грибков в работе Satoh et al. (2009). Авторы изучили один дрожжевой изолят из выделений наружного слухового прохода пожилого пациента одной из городских больниц Токио, используя биохимические тесты и последовательности генов рибосомальной РНК (ITS и D1-D2) для формального определения нового вида C. auris. Примерно в те же сроки Kim et al. (2009) сообщили о 15 изолятах нового вида Candida, который в настоящее время подтвержден как C. auris, из ушных каналов пациентов с хроническим средним отитом в Южной Корее. Эти изоляты были чувствительны к относительно высоким концентрациям амфотерицина В и флуконазола. Последующее исследование из Южной Кореи, проведенное Lee et al. (2011), установило, что C. auris является возбудителем смертельной фунгемии с собственной и приобретенной резистентностью к флуконазолу.
Эти две группы обратили внимание на неправильную идентификацию C. auris коммерческими системами. Они также подчеркнули ценность секвенирования внутреннего транскрибированного спейсера (ITS) в качестве подтверждающего теста. Группа Теуна Бёкхоута переклассифицировала комплекс видов Candida haemulonii, выделив C. haemulonii, C. haemulonii var. vulnera, Candida pseudohaemulonii, Candida duobushaemulonii и C. auris. Примечательно, что эти исследователи сообщили, что MALDI-TOF MS не уступает ITS-секвенированию для целей идентификации (Cendejas-Bueno et al., 2012). Таким образом, за короткий промежуток времени в 4 года была охарактеризована редкая группа видов грибков с присущей им антифунгальной резистентностью с точки зрения клинического значения, а тест MALDI-TOF MS был рекомендован для быстрой лабораторной идентификации.
Алгоритм диагностики Candida auris
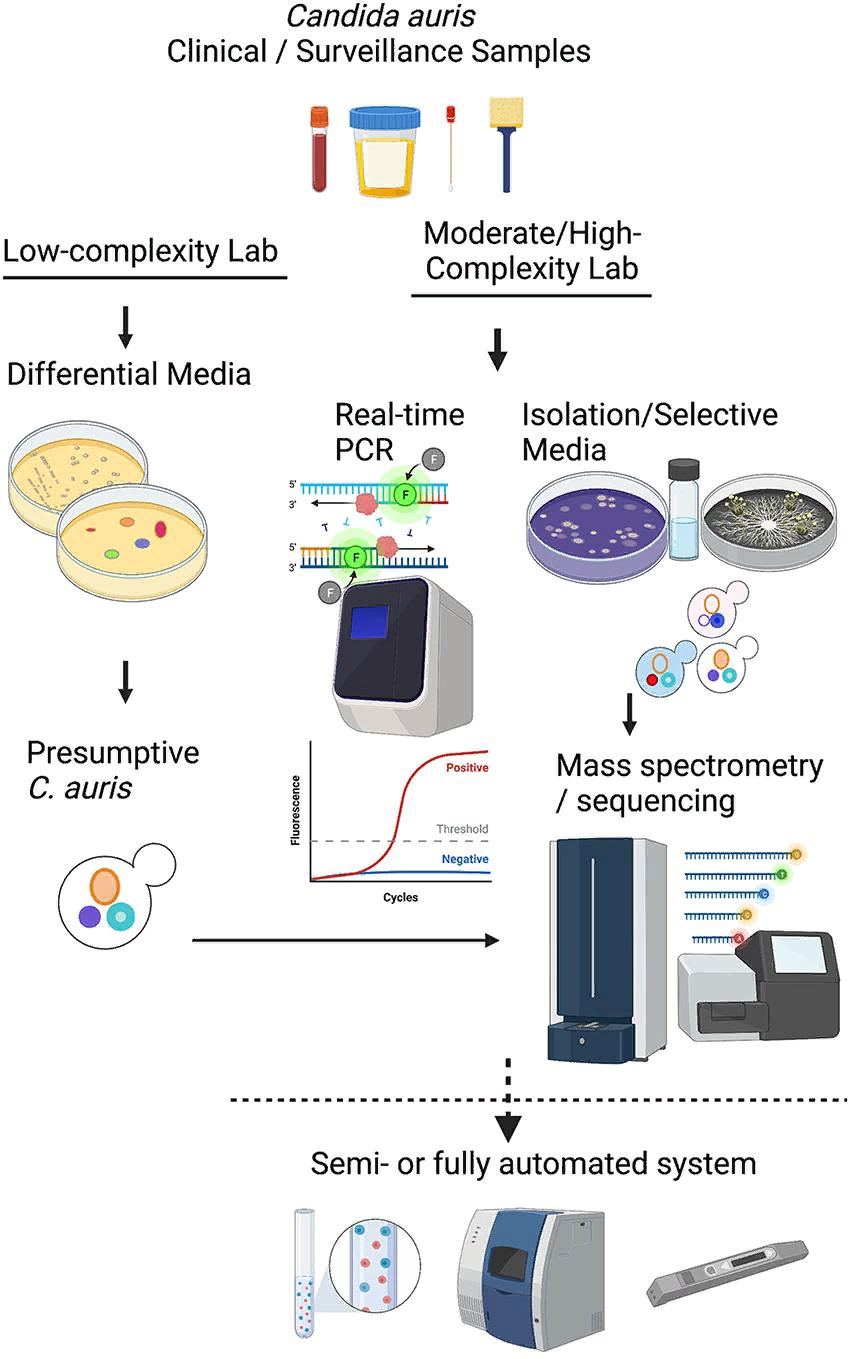
Колонизация и инфицирование Candida auris среди госпитализированных пациентов и лиц, находящихся на длительном лечении, стали глобальной проблемой, локальные вспышки которой были зарегистрированы в нескольких странах. Возможны несколько лабораторных режимов работы, связанных с выделением возбудителя, быстрой идентификацией, тестированием на восприимчивость и генотипированием. На рисунке 1 представлена концептуальная иллюстрация различий в методах тестирования между слабо оснащенными лабораториями и лабораториями умеренной и высокой оснащенности. Важной задачей для специализированных диагностических микологических лабораторий является поддержка эпиднадзора за C. auris и расследования вспышек.
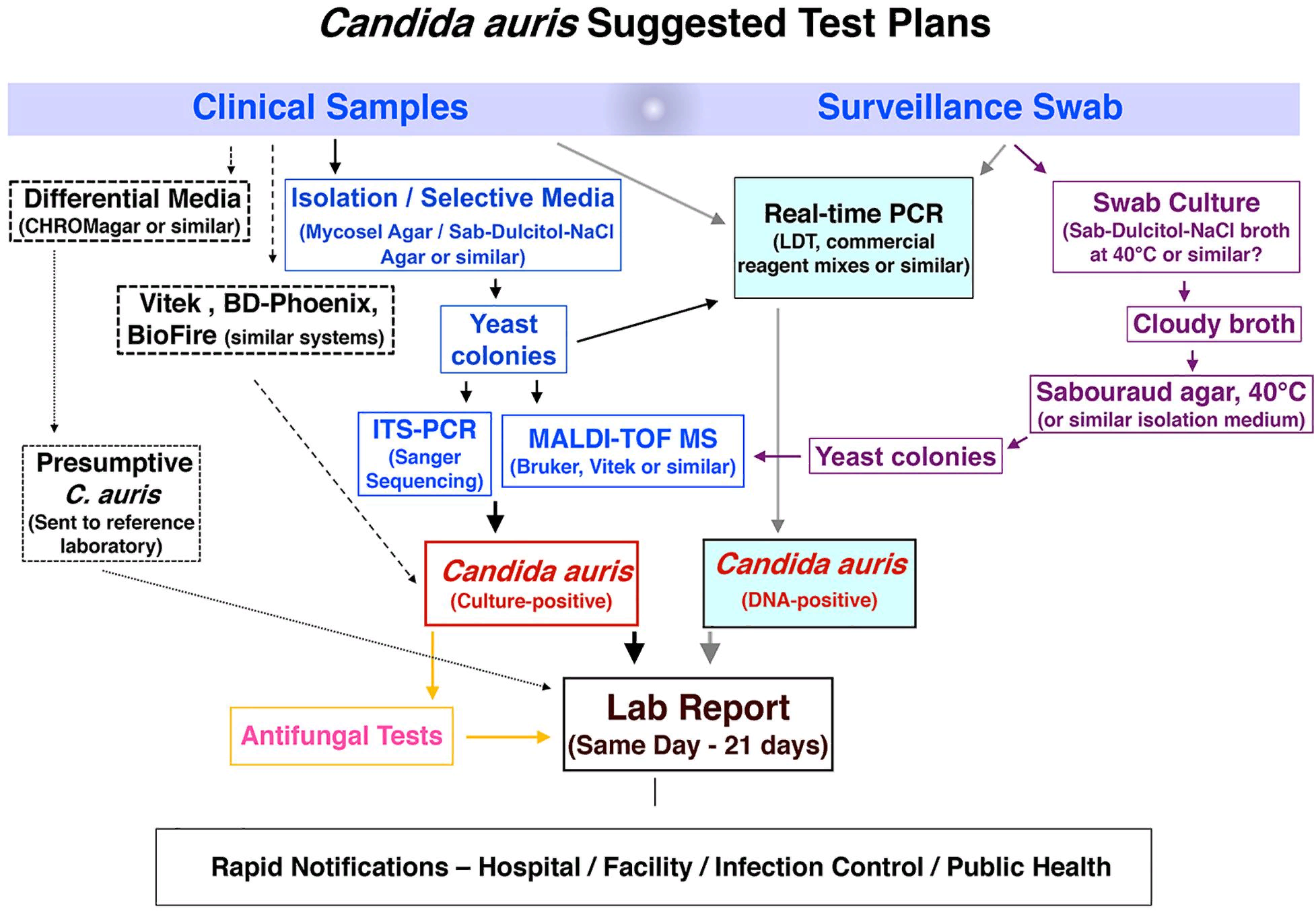
Такая услуга доступна в крупных бактериологических лабораториях, но редко требуется для грибковых патогенов. Поэтому было опубликовано множество клинических рекомендаций и руководств для лабораторий, которые работают с C. auris или хотят расширить спектр своих услуг. В США в последних версиях документа CLSI M-54 и Руководства по клинической микробиологии, рекомендованных коллегами для лабораторий диагностической микробиологии, отсутствуют специфические для C. auris рекомендации по выделению и идентификации (Carroll et al., 2019; CLSI, 2021). В начале 2017 года мы разработали алгоритм, который с тех пор регулярно модифицировали, чтобы справиться с беспрецедентным объемом эпиднадзорных и клинических образцов C. auris. Альтернативные лабораторные подходы показаны пунктирными линиями. Мы делимся этой схемой в надежде, что она поможет другим лабораториям модифицировать свои рабочие процессы в соответствии с местными потребностями (рис. 2).
Горизонты диагностики Candida auris.
Среди коммерческих продуктов, которые, вероятно, скоро появятся, T2MR (T2 магнитный резонанс) - портативная система, которая выявляет кандидемию путем измерения сигналов от ПЦР-амплифицированных кластеров наночастиц Candida в крови непосредственно в течение 3 ч (Neely et al., 2013; Mylonakis et al., 2015). В 2018 году исследователи CDC оценили панель T2Cauris (T2 Biosystems, Lexington, MA, США) с образцами мазков из подмышечной впадины/паховой области и сообщили о 89% чувствительности и 98% специфичности для выявления C. auris (Sexton et al., 2018a;).
На сайте T2Biosystems® указано, что T2Cauris не разрешен для диагностического тестирования и доступен только для исследовательского использования (RUO). MONODOSE dtec-qPCR C. auris - коммерческий готовый к использованию набор qPCR для выявления патогена (Genetic PCR SolutionsTM, Аликанте, Испания). Производитель завершил валидационное исследование с академическими партнерами в соответствии со стандартом UNE-EN ISO/IEC 17025:2005 (Martinez-Murcia et al., 2018). Исследователи сообщили, что MONODOSE dtec-qPCR C. auris прошел валидацию в двух независимых лабораториях и готов к клинической оценке (Martinez-Murcia et al., 2018). Среди новых систем "образец-ответ" ePlex BCID-FP - это патентная панель тестов на 15 видов Candida, используемая с помощью запатентованной системы ePlex System (GenMark Diagnostics, Inc., Карлсбад, Калифорния, США).
Мультилабораторная оценка с использованием 3 изолятов C. auris и 49 искусственных образцов крови дала 100% чувствительность и специфичность (Zhang et al., 2020). Другой подход "образец-ответ" на основе олигонуклеотидной функционализированной наносистемы для C. auris достиг 85% чувствительности и 100% специфичности в ограниченном тестировании с 22 образцами крови (Pla et al., 2021). Масс-спектрометрические системы других производителей, кроме Bruker, также доступны и используются в клинических лабораториях. Минимальная оценка с двумя изолятами C. auris показала равную эффективность систем Vitek MS и Autof MS 1000 (Yi et al., 2021).
Можно с уверенностью сказать, что любой аппарат MALDI-TOF MS обеспечит идентификацию C. auris при условии включения в базу данных достаточно репрезентативных изолятов, охватывающих все известные клады, для обучения алгоритма принятия решения (van Belkum et al., 2017). Также публикуются ограниченные, но многообещающие результаты по обработке образцов и применению машинного обучения для платформ MALDI, что в конечном итоге принесет пользу диагностике C. auris (Muthu et al., 2018; Weis et al., 2020; De Bruyne et al., 2021).