КОВИД показал, что мы должны изучать иммунитет всего организма - давайте разберемся с логистикой для получения нужных образцов.
В самом начале пандемии моя исследовательская группа обнаружила нечто удивительное (Донна Л. Фарбер - профессор хирургии, микробиологии и иммунологии в Медицинском центре Ирвинга Колумбийского университета в Нью-Йорке, штат Нью-Йорк, США - прим.пер.).
У тяжелобольных пациентов COVID-19, находившихся на ИВЛ, ежедневные смывы из пластиковых трубок содержали иммунные клетки их дыхательных путей. Что еще более удивительно, то, что было в этих образцах дыхательных путей, сильно отличалось от того, что обнаруживалось в крови того же пациента.
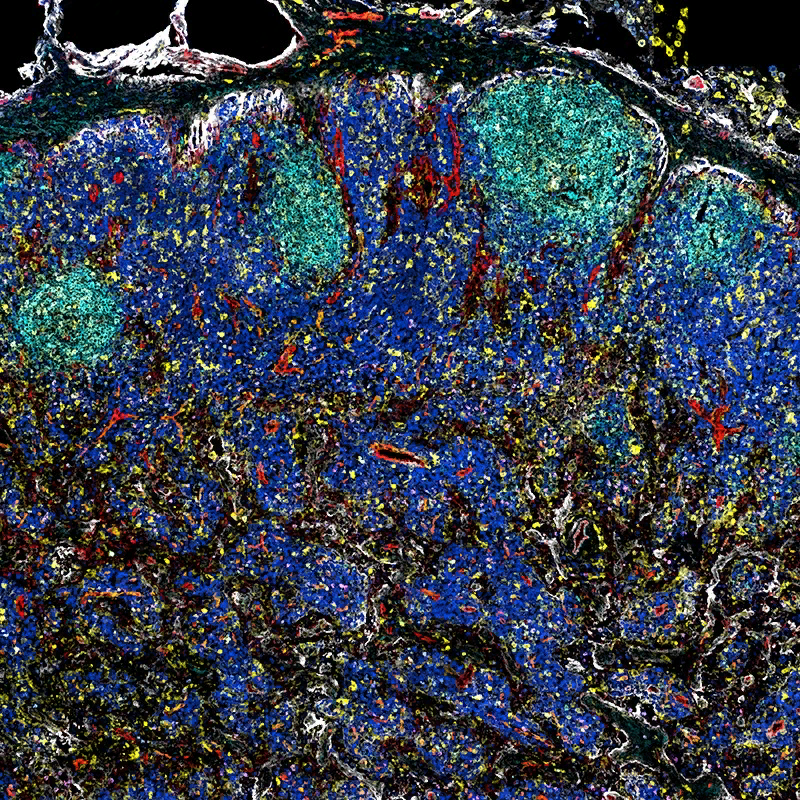
Иммунные клетки имеют определенные локализации. В этом лимфатическом узле цвета обозначают типы клеток: В-клетки (светло-голубые) и Т-клетки (темно-синие и зеленые). Credit: Andrea Radtke.
Клетки дыхательных путей вырабатывали высокий уровень цитокинов - факторов, которые привлекают иммунные клетки, такие как Т-клетки, к участку ткани и способствуют развитию воспаления. Напротив, в соответствующих образцах крови было мало Т-клеток, но много других иммунных клеток - моноцитов, которые демонстрировали необычный паттерн рецепторов клеточной поверхности. В образцах легких умерших пациентов были обнаружены моноциты и макрофаги, группирующиеся в альвеолах; это связано с повреждениями, характерными для тяжелой формы COVID-19. Необычные рецепторы навели нас на мысль, что моноциты, циркулирующие в крови, были как видоизменены, так и активированы цитокинами, вырабатываемыми в дыхательных путях. Если бы мы не собрали как образцы дыхательных путей, так и образцы крови, мы бы не смогли соединить эти фрагменты вместе.
Как показывает этот пример, пандемия выявила серьезные пробелы в нашем понимании иммунной системы человека. Один из самых больших - это иммунные реакции в тканях - в местах инфекции и там, где она манифестирует.
Иммунные клетки часто называют белыми кровяными тельцами. Однако большинство из них, включая более 95% Т-клеток, обитают и функционируют в тканях, особенно в лимфоидных органах - таких как костный мозг, селезенка и лимфатические узлы - и в барьерных поверхностях, таких как кожа, кишечник и слизистые оболочки. Хотя инфицирование коронавирусом SARS-CoV-2 приводит к появлению вирусоспецифических CD4+ и CD8+ Т-клеток, которые обнаруживаются в крови в течение нескольких месяцев или дольше, неясно, что их присутствие в циркулирующей крови означает для тканевого иммунитета в легких - или в других местах.
Некоторые иммунные клетки никогда не обнаруживаются в крови. (Вернее, во многих случаях мы не знаем, попадают ли они в кровь или меняют свои свойства, когда попадают). Некоторые, такие как макрофаги, возникают непосредственно из эмбриональных клеток-предшественников и созревают в таких тканях, как легкие, печень и селезенка. Другие, такие как Т-клетки памяти, развиваются из активированных Т-клеток, которые мигрируют в ткани после прайминга в лимфатических узлах во время инфекции. Эти тканевые Т-клетки надолго поселяются в тканях и могут развивать свойства, характерные для каждой из этих тканей.
Для полного понимания иммунной системы исследователям необходимо понять иммунитет дыхательных путей, кишечника и кожи, а также то, как каждый из них взаимодействует с близлежащими лимфатическими узлами.
Это означает необходимость расширения инфраструктуры для получения образцов тканей: создание альянсов с клиницистами, биобанками, больницами и агентствами по закупке донорских органов.
В данном материале я рассказываю о том, как проводить такие исследования и чему можно научиться.
Мышиные модели
Мышиные модели инфекции, аутоиммунитета, рака и воспалительных заболеваний чрезвычайно ценны для понимания иммунной системы. Для исследований на мышах обычно берутся образцы пораженных органов и соответствующих лимфатических узлов, но редко - крови, поскольку объемы этих образцов очень малы. Эти специфические исследования выявили фундаментальные процессы - например, что вирусная инфекция дыхательных путей побуждает дендритные (антигенпрезентирующие) клетки мигрировать из легких в соседние лимфатические узлы, где они стимулируют специфические к вирусу Т-клетки, такие как CD4+ Т-хелперные клетки. Этот прайминг способствует дифференцировке В-клеток и выработке антител; также вырабатываются цитотоксические CD8+ Т-клетки, которые мигрируют в легкие для уничтожения инфицированных клеток и предотвращения распространения вируса. После того как инфекция ликвидирована, небольшая популяция этих вирусоспецифических Т- и В-клеток памяти сохраняется в тканях, готовая быстро начать защитную реакцию при повторной встрече с патогеном.
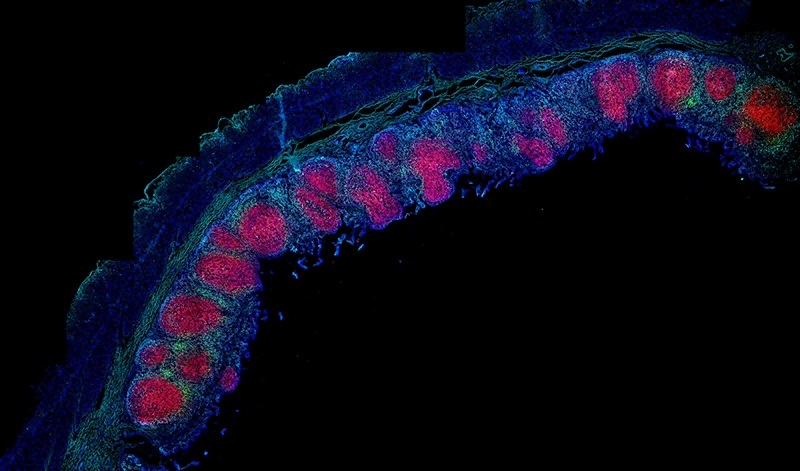
Иммунные клетки в кишечнике организованы пространственно: продуцирующие антитела В-клетки (красные) окружены Т-клетками (светло-голубые).Credit: Takashi Senda.
Исследования на мышах также показали, что для вирусов, специфичных для конкретного участка организма, таких как грипп или вирус папилломы человека, иммунологическая память поддерживается специальными субпопуляциями Т-клеток памяти на соответствующем участке. Эти тканерезидентные Т-клетки памяти обнаруживаются в легких для респираторных вирусов, в коже для кожных патогенов и в женском репродуктивном тракте для генитальных инфекций. Более того, эти резидентные клетки памяти могут защищать от инфекции и могут быть созданы вакцинами, направленными на конкретные ткани, например, интраназальными вакцинами против гриппа.
У людей сложно отслеживать иммунный ответ от начала инфекции до развития иммунологической памяти. Не всегда ясно, где и когда начинается инфекция, а отбор образцов соответствующих тканей на протяжении определенного времени не является простым делом.
Однако у людей достаточно много крови, которую можно регулярно собирать. Кровь содержит все основные линии иммунных клеток, а также циркулирующие антитела и секретируемые цитокины. Этот подход оказался бесценным для мониторинга иммунных реакций в режиме реального времени, а также для понимания образования и функционирования антител и воспаления.
В случае с SARS-CoV-2 исследование крови помогло отследить реакцию на инфекцию и вакцины, а также найти корреляты тяжелой формы заболевания. Но многое еще неизвестно, потому что основная часть иммунных действий происходит в тканях.
Уроки изучения тканей
Исследования иммунитета в тканях привели к разработке методов лечения. При аутоиммунных заболеваниях, таких как ревматоидный артрит, в сыворотке крови повышается множество маркеров воспаления. Когда исследователи изучили синовиальную жидкость, заполняющую пространство между суставами человека, они обнаружили высокий уровень цитокина TNF-α, который, как выяснилось, в конечном итоге и является инициатором этого заболевания. В настоящее время анти-TNF-α блокаторы являются одними из наиболее часто назначаемых препаратов для лечения ревматоидного артрита и других воспалительных заболеваний, и они чрезвычайно эффективны в симптоматическом лечении.
Аналогичным образом, исследование иммунных клеток в опухолях, которые были хирургически удалены или подвергнуты биопсии, выявило функционально неактивные Т-клетки, которые не смогли удалить больные клетки. Это навело на мысль о том, что многие виды рака могут уклоняться от иммунной защиты. Такие исследования послужили обоснованием для иммунотерапии опухолей, которая произвела революцию в лечении некоторых видов рака молочной железы, легких, толстой кишки и других видов рака.
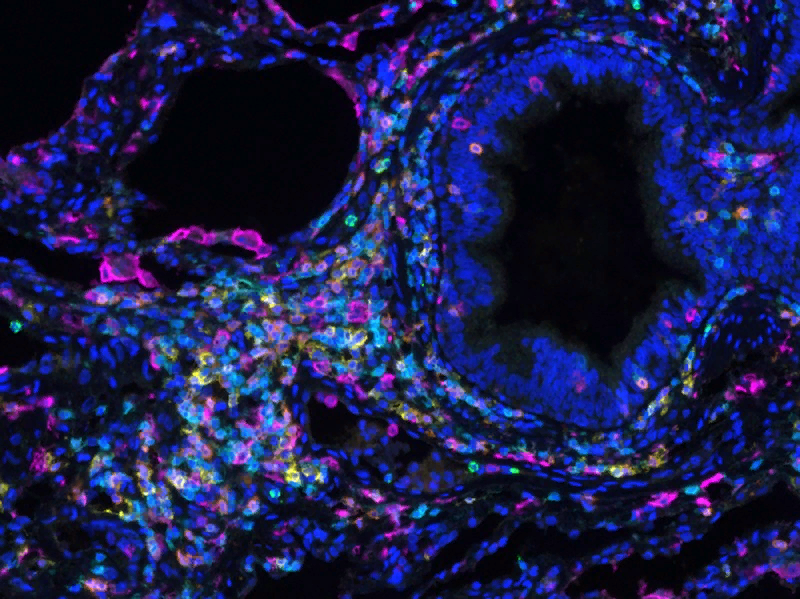
Пространственная организация иммунных клеток в легком. Т-клетки (синие и оранжевые) группируются вокруг основных дыхательных путей справа, но не вокруг альвеол, в которых происходит обмен газов с кровью. Credit: Stuart Weisberg.
Наши работы и работы других авторов показывают, что состав иммунных клеток отличается в разных тканях, при этом существуют тканеспецифические различия в экспрессии генов, метаболических путях и функциональной регуляции. Определение этих свойств позволяет направлять терапию на иммунные ответы тканей - но для этого необходимо сначала изучить ткани.
Многие образцы тканей живых людей могут быть собраны во время обычного медицинского обслуживания. Например, биопсии и плановые операции позволяют собрать больные и здоровые ткани.
При операциях, от тонзиллэктомии до удаления опухолей, удаляются и утилизируются лимфатические узлы. Кардиохирурги обычно удаляют и утилизируют тимус. При операциях по шунтированию желудка и кишечника удаляются ткани кишечника, богатые иммунными клетками, и лимфатические узлы, связанные с кишечником. Такие образцы особенно полезны для изучения пространственной организации иммунных клеток в этих тканях, что может подсказать, как типы клеток взаимодействуют друг с другом и влияют друг на друга.
Десять лет назад моя группа создала новый тип тканевого ресурса для получения образцов от доноров органов. Мы связались с местной некоммерческой организацией в Нью-Йорке под названием LiveOnNY, которая координирует донорство органов и сотрудничает с исследователями и семьями, давшими согласие. В рамках этого сотрудничества моя группа имеет дежурного хирурга, готового отреагировать, когда координатор трансплантации сообщит им о смерти потенциального донора.
После того как клинические бригады получают органы человека для трансплантации, наш хирург собирает ткани для исследований - включая кишечник, легкие, многие лимфатические узлы, тимус, селезенку, костный мозг, кожу, миндалины и слюнные железы - и доставляет все непосредственно в лабораторию для обработки и хранения образцов. Объединение сбора тканей с донорством органов - лучший способ сохранить наибольшее количество тканей и наиболее жизнеспособные образцы. Пока результаты, полученные из этих тканей, соответствуют результатам, полученным из тканей живых пациентов, хотя сравнение результатов параллельно не всегда возможно.
К настоящему времени мы получили ткани более чем от 500 доноров. Мы поделились образцами со многими сотрудничающими исследователями и профилируем их в рамках Атласа клеток человека, целью которого является создание всеобъемлющих справочных карт всех клеток человека.
Исследовательские группы в Институте Веллкома Сангера в Хинкстоне, Великобритания, и Каролинском институте в Стокгольме создали аналогичные программы для получения образцов тканей. Университет Флориды в Гейнсвилле наладил сотрудничество со многими организациями по заготовке органов, первоначально для получения образцов поджелудочной железы для исследования диабета 1 типа (программа nPOD).
Благодаря технологическому прогрессу транскрипты РНК, содержание белков и модификации генов можно точно определить даже для отдельных клеток. В сочетании с вычислительным анализом эти измерения позволяют одновременно идентифицировать состав, линию и функциональное состояние иммунных клеток. Применительно к клеткам крови такое детальное профилирование позволило выявить иммунные сигнатуры для определенных инфекций и вакцин, от гриппа до SARS-CoV-2.
Моя группа и другие исследователи сравнили различные ткани сотен индивидуальных доноров, чтобы определить различные типы врожденных и адаптивных иммунных клеток в каждой из них. Наши текущие исследования включают определение того, как иммунные профили тканей коррелируют с такими факторами, как пол и возраст.
Образцы донорских органов позволяют получить моментальные снимки иммунного статуса только в один момент времени. Одна из самых сложных задач - проследить с течением времени иммунный ответ на инфекцию, вакцинацию или другие виды иммунной терапии в конкретных тканях.
Это позволило бы изучить, например, изменения, происходящие с возрастом или ухудшением состояния здоровья.
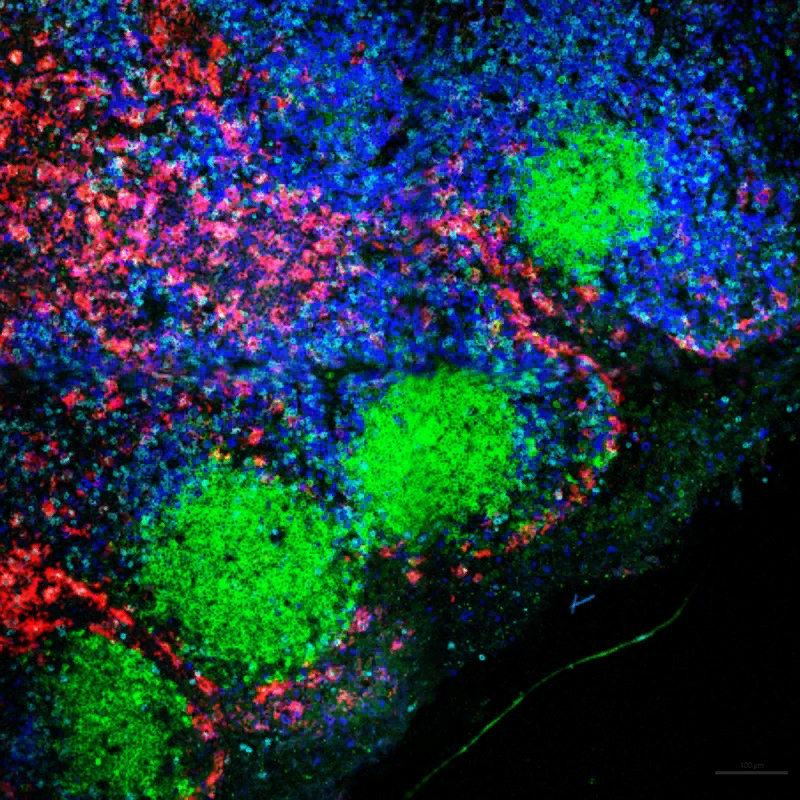
Иммунные клетки в ткани обнаруживаются в определенных местах лимфатического узла: В-клетки, продуцирующие антитела (зеленые), находятся в круглых фолликулах, частично окруженные Т-клетками (синие) с макрофагами (красные) на периферии. Credit: Basak B. Ural.
Три этапа
Что могут сделать исследователи, учреждения и благотворители для продвижения работы в области иммунитета тканей человека? У меня есть три рекомендации.
Поощряйте парный отбор проб. Клиницисты и иммунологи должны находить больше возможностей для парного забора крови и тканей, например, путем получения дыхательных смывов у интубированных пациентов или носовых смывов у детей и взрослых, страдающих респираторными заболеваниями. (Назальные смывы практически неинвазивны, поэтому их также можно использовать для сопоставления со здоровыми контрольными группами). Парные образцы можно взять у людей, проходящих диагностическую биопсию (например, во время колоноскопии кишечника) или исследовательскую биопсию с помощью тонкоигольной аспирации (например, из кожи и лимфатических узлов).
Эти исследования позволяют установить, как иммунные параметры в крови и соответствующих тканях коррелируют друг с другом, с заболеванием и его исходом. Например, исследователи, изучающие вакцину против гепатита В, собирали образцы лимфатических узлов вблизи места инъекции, чтобы сравнить реакцию иммунных клеток там с реакцией в крови. В исследовании вируса Varicella zoster, который вызывает ветряную оспу и может реактивироваться, вызывая опоясывающий лишай, изучались Т-клетки в коже вблизи места введения антигена вируса.
Подходы, разработанные в ходе текущей пандемии, свидетельствуют о том, что образцы, которые еще год назад было невозможно проанализировать, теперь могут предоставить углубленные данные. К ним относятся назальные мазки, используемые для тестирования на SARS-CoV-2, которые содержат достаточно клеток для высокочувствительного профилирования отдельных клеток. Экспрессия генов может быть измерена в отдельных клетках, что помогает составить картину иммунного ответа. Эти методы могут быть применены к другим участкам забора образцов при других видах инфекций и заболеваний, так что даже рутинные медицинские процедуры могут предоставить материал для иммунологических исследований.
Адаптация коллекций биобанков. В мире существуют десятки биобанков; самые крупные содержат образцы от сотен тысяч людей. Однако, как правило, эти образцы не являются полезными для иммунологов. Вместо того чтобы консервировать образцы химическим способом или хранить только ДНК, плазму или сыворотку, биобанки должны также хранить замороженные ткани и выделения, полные иммунных клеток и растворимых факторов. Например, для изучения астмы и других хронических заболеваний легких были созданы биобанки различных респираторных секреций, включая мокроту, слюну, носовые мазки и бронхиальные отделяемое. Изучение сохранившихся иммунных клеток в этих образцах может расширить наше понимание мукозального иммунитета.
Поддержка и оптимизация сотрудничества. В настоящее время каждому иммунологу для получения образцов тканей для исследований приходится связываться с клиницистами в каждом конкретном случае. Многие институты и клиники создали центральные подразделения для получения этического одобрения или одобрения институционального совета, используя клинических координаторов для получения согласия пациентов на взятие образцов. Однако эти центры, как правило, связаны с клиническими, а не фундаментальными кафедрами.
В прошлом иммунологические исследования проводились в отделениях патологии, которые получали все клинические образцы и распределяли их среди исследователей. Пришло время возродить эти старые союзы и установить более глубокие связи между иммунологами и клиницистами, работающими с пациентами. Иммунологи должны добиваться совместных встреч в клинических отделениях. Ученые-клиницисты должны стажироваться в иммунологических лабораториях. Совместные проекты между этими двумя областями должны стать обычным явлением и выходить далеко за рамки получения образцов.
Необходимо финансирование и программы для работы иммунологов с гериатрами, чтобы узнать, что приводит к ослаблению иммунной системы. Педиатры и иммунологи должны сотрудничать не только в вопросах детской аллергии, но и в понимании детского иммунитета и развития иммунной системы. Иммунология должна быть привлечена ко многим другим дисциплинам, которые обычно с ней не связаны, например, к неврологии.
По мере того как SARS-CoV-2 продолжает опустошать мир, возникает новая необходимость в налаживании сотрудничества, которое поможет решить сложные вопросы в иммунологии человека. Чтобы продвинуть эту область и перевести полученные результаты в лечение, иммунологи должны иметь возможность изучать весь организм.