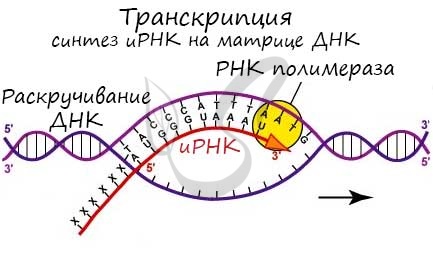
Транскрипция - это фундаментальный процесс во всех клетках, в ходе которого генетическая информация копируется с шаблона ДНК в РНК-мессенджер.
У бактерий эволюционно консервативная мультисубъединичная ДНК-зависимая РНК-полимераза (RNAP) является основным ферментом, который отвечает за транскрипцию. Являясь первым и центральным этапом экспрессии генов, транскрипция регулируется различными транскрипционными факторами. Кроме того, бактериальная RNAP является не только идеальной исследовательской моделью для всех клеточных RNAP, но и важной мишенью для разработки антибактериальных препаратов. Таким образом, понимание бактериальной транскрипции и того, как она регулируется различными транскрипционными факторами, имеет важное значение.
Транскрипционные факторы, которые объединяют клеточные и экологические сигналы для контроля клеточной биологии, хорошо известны у бактерий. Нацеливаясь на промоторы RNAP или/и ДНК, они могут включать или выключать экспрессию генов, позволяя бактериям адаптироваться к стрессовым условиям и выживать в них. Эти факторы часто называют "глобальными регуляторами", поскольку они могут контролировать экспрессию многих генов. Некоторые из этих регуляторов также могут интегрировать множество сигналов для точной настройки экспрессии генов, что позволяет бактериям реагировать на сложные и динамичные условия окружающей среды.
Основной целью данного обзора было раскрытие роли транскрипционных факторов у бактерий и их реакции на клеточные изменения с целью углубления нашего понимания механизмов патогенности у различных видов бактерий. Недавно по этой теме были опубликованы четыре статьи, дающие дополнительное представление о роли глобальных транскрипционных факторов в бактериальной адаптации и вирулентности.
Pellegrini et al. изучали роль транскрипционного фактора CodY в контроле и координации метаболизма и вирулентности у стрептококков группы В (GBS). Они подтвердили, что CodY необходим для инфицирования GBS в неонатальных и взрослых животных моделях, но не является необходимым для роста GBS в сложной или химически определенной жидкой среде. Удаление гена CodY снижало летальность in vivo, что было связано с ухудшением способности мутанта сохраняться в кровотоке, распространяться в отдаленные органы и пересекать гематоэнцефалический барьер. Кроме того, CodY способствует адгезии GBS к эпителиальным клеткам и контролирует образование биопленок GBS.
В ходе транскриптомного анализа было установлено, что CodY регулирует ~13% генома GBS, в основном функционируя как супрессор генов, связанных с транспортом и метаболизмом аминокислот, а также генов, кодирующих поверхностно-связанные белки. Интересно, что в отличие от снижения вирулентности и способности преодолевать гематоэнцефалический барьер штаммом с удаленным CodY, уровень Srr2 значительно повышен, что указывает на участие дополнительного регуляторного фактора. Также было показано, что активность CodY зависит от присутствия аминокислот с разветвленной цепью, которые выступают в качестве универсальных кофакторов для этого регулятора. В данной работе авторы представили подробное исследование роли CodY, контролирующего вирулентность GBS.
Репрограммирование экспрессии генов вирулентности имеет решающее значение для выживания бактерий и их адаптации к различным условиям среды обитания хозяина. Pettersen et al. исследовали глобальные транскрипционные реакции Streptococcus pneumoniae (пневмококк) на компоненты человеческой крови и спинномозговой жидкости (ЦСЖ), полученные из отбракованных и обезличенных образцов пациентов. Полученные данные показали значительные изменения в транскриптоме пневмококка при инкубации с компонентами человеческой крови и ЦСЖ.
Было установлено, что клеточные компоненты крови являются основными стрессовыми факторами для пневмококка в кровотоке, в то время как компоненты плазмы в основном вызывают реакцию метаболической адаптации. Примечательно, что изменения, наблюдаемые в образцах ЦСЖ, были аналогичны изменениям, наблюдаемым в образцах плазмы, что объясняется их сходством. Кроме того, более 20 малых некодирующих РНК были идентифицированы как дифференциально экспрессируемые в ответ на различные условия, особенно в ответ на воздействие эритроцитов. Авторы подчеркнули участие метаболических путей, таких как биосинтез жирных кислот и нуклеотидов, а также регуляции, опосредованной не кодирующей РНК, в вирулентности пневмококка.
Бактериальная резистентность к противомикробным препаратам представляет собой значительную угрозу для здоровья человека и животных во всем мире, а метаболизм бактерий связан с чувствительностью и сопротивляемостью к антибиотикам. Mao et al. изучили роль глобального транскрипционного регулятора FNR в метаболизме и его вклад в резистентность к антибиотикам у Edwardsiella tarda. Удаление гена fnr привело к повышению чувствительности к аминогликозидным антибиотикам. Это связано с наибольшей активацией метаболизма аланина, аспартата и глутамата и цикла P, что способствовало увеличению протонной движущей силы. Примечательно, что экзогенный глутамат оказывал такой же эффект, как и делеция FNR, в повышении чувствительности к аминогликозидным препаратам. Исследование позволяет сделать вывод, что FNR может регулировать метаболизм глутамата, способствуя резистентности к аминогликозидам у Edwardsiella tarda.
Работа Zhao et al. была посвящена механизму транскрипционной регуляции MsmR1 в Paenibacillus polymyxa SC2 для расширения его потенциального применения в биологическом контроле против конкретных бактерий порчи перца. Было показано, что делеция MsmR1 снижает синтез полимиксина. Далее был проведен анализ иммунопреципитации хроматина с секвенированием (ChIP-seq) в сочетании с анализом сдвига электромобильности (EMSA) для описания регуляторной сети глобального регулятора MsmR1, что указывает на значительную связь между MsmR1 и путями углеводного метаболизма. MsmR1 положительно регулирует синтез полимиксина путем прямого связывания с промоторами oppC3 и sdr3, а также цитратный цикл путем прямого связывания с промотором sucA. Кроме того, MsmR1 регулирует множество биологических процессов, включая углеводный обмен, образование биопленок, хемотаксис и подвижность. Эти результаты подтверждают возможность применения Paenibacillus polymyxa SC2 для биологического контроля против различных патогенных бактерий в перце.
В заключение следует отметить, что транскрипционные факторы необходимы для выживания и адаптации бактерий. Хотя многие транскрипционные факторы были идентифицированы, их функции все еще плохо изучены и могут быть различными у разных штаммов бактерий. Для мониторинга активности транскрипционных факторов в реальном времени в живых бактериях необходимо разработать ряд новых методов. Интеграция данных из нескольких источников, таких как транскриптомика, протеомика и метаболомика, может обеспечить более полное понимание сложной регуляции, управляемой транскрипционными факторами и их комбинациями. Лучшее понимание бактериальных транскрипционных факторов может дать представление об адаптации к стрессам, помочь в разработке новых стратегий для предотвращения бактериальных инфекций и способствовать использованию бактерий в биотехнологии, сельском хозяйстве и других отраслях.