Резистентность к противомикробным препаратам (AMR) является естественным эволюционным следствием, вызванным массовым использованием антибиотиков.
Существенное повышение уровня AMR и его распространение во многом объясняется неправильным использованием антибиотиков, их производством и утилизацией остатков в окружающей среде. Ожидается, что в 2023 году число смертей, связанных с AMR и способствующих ему, превысит 4,5 миллиона в связи с глобальным распространением AMR среди клинически важных патогенов. Кроме того, проблема AMR мешает решению других клинических задач, таких как трансплантация органов, трансплантация микробиома и лечение воспаления при хронических метаболических заболеваниях, что приводит к низким показателям успеха.
Для преодоления кризиса AMR и поиска новых антибиотиков или альтернатив антибиотикам, несколько глобальных инициатив находятся на разных стадиях завершения. В настоящем обзоре представлены обновленные исследовательские инициативы, расширяющие набор инструментов против AMR-патогенов за счет:
(i) повторного применения уже одобренных препаратов, обычно используемых для лечения неинфекционных заболеваний;
(ii) антибиотиков-потенциаторов, которые не являются антибактериальными препаратами, а блокируют функции резистентности или повышают проницаемость мембран, усиливая тем самым активность антибиотиков;
(iii) синергетических комбинаций антибиотиков;
(iv) альтернативных методов лечения для минимизации использования антибиотиков.
Восстановление антибактериальной активности клинически важных антибиотиков, которые с годами утратили свою эффективность из-за снижения поглощения патогенами или распространения специфических функций резистентности в организмах путем горизонтального переноса генов, имеет большое значение для здравоохранения.
Chawla et al. обобщили текущее состояние дел в области открытия и разработки потенцирующих средств и их способов действия против резистентных к антибиотикам патогенов. Неантибиотические соединения, которые восстанавливают чувствительность устойчивых патогенов, называются потенциаторами или адъювантами антибиотиков. Потенциаторы работают только в сочетании с антибиотиками и повышают их эффективность против устойчивого патогена. Авторы обсудили различные возможные способы действия потенциаторов, такие как прямое ингибирование ферментов резистентности или эффлюксных насосов или снижение стабильности, наследования и распространения векторов, несущих гены резистентности. Для открытия и разработки новых антибиотиков-потенциаторов использовались как природные, так и синтетические соединения. Ингибиторы β-лактамаз являются наиболее часто используемыми потенцирующими средствами в клинической практике.
Работа Kumar et al. в основном была посвящена открытию и разработке соединения, обладающего антибиопленочной и потенцирующей активностью. Авторы сообщили, что гуанидиновое производное серебра может действовать как потенцирующее средство для колистина в отношении резистентных к препаратам Acinetobacter baumannii и других грамотрицательных патогенов, резистентных к колистину. Нанопрепарат, состоящий из наночастиц серебра и самособирающегося гуанидиния, также обладает бактерицидной активностью против планктонных и связанных с биопленкой микроорганизмов. Выявленное соединение помогает колистину нарушать целостность мембран бактериальных клеток. Такие соединения потенциально могут быть использованы для стерилизации хирургического оборудования и поверхностей в отделениях интенсивной терапии, где патогены с множественной лекарственной резистентностью вызывают первостепенную клиническую озабоченность.
Liu et al. обнаружили ингибитор эффлюксного насоса, фенилаланин-аргинин-нафтиламид (PAβN), который, как выяснилось, повышает антимикробную активность аминогликозидного антибиотика неомицина в отношении Riemerella anatipestifer, грамотрицательной бактерии, вызывающей септицемию. PAβN конкурирует с неомицином за один и тот же эффлюксный насос, повышая эффективность неомицина против резистентного к аминогликозидам R. anatipestifer. Экспериментальные наблюдения in vitro и in vivo показывают, что PAβN может потенцировать активность неомицина против резистентных к неомицину R. anatipestifer.
Синергический эффект между структурно различными антибиотиками может существенно повысить эффективность противомикробных препаратов, которые при одиночном применении лишь замедляют рост резистентного патогена. Такая комбинированная терапия потенциально может ограничить появление и распространение резистентных патогенов. В исследовании, проведенном Al-Marzooq et al., изучался синергетический эффект неапептида полимиксина В (PMBN), производного полимиксина, с аминогликозидной группой антибиотика азитромицина (AZT). В различных штаммах грамотрицательной модельной бактерии Escherichia coli PMBN существенно повышает эффективность AZT, хотя минимальная ингибирующая концентрация (МИК) AZT у анализируемых штаммов очень высока. Генетический анализ показал, что комбинации PBN и AZT могут нейтрализовать функции резистентности макролидной фосфотрансферазы, кодируемой mphA; однако этот синергетический эффект не является значительным в штамме, несущем дополнительный ген ermB, который кодирует макролидную метилазу. Авторы предположили, что PMBN увеличивает проницаемость AZT путем частичного вмешательства в проницаемость внешней мембраны тестируемых штаммов E. coli.
Исследование, проведенное Xu et al., было посвящено синергетической активности колистина и нарингенина, флавоноида, относящегося к подклассу флаванонов, против колистин-резистентных грамотрицательных патогенов, инфицирующих Galleria mellonella. Авторы сообщили, что комбинация нарингенин-колистин также ингибирует образование биопленок и снижает микробную нагрузку в матрице биопленки. Синергетическая антибактериальная активность приводит к увеличению проницаемости мембраны из-за потери целостности внешней мембраны, что облегчает действие антибиотиков для очищения микробных инфекций у G. mellonella.
Mirzaei et al. исследовали синергетический эффект мелиттина, 26-аминокислотного основного пептида, вырабатываемого медоносной пчелой в своем яде, с ванкомицином и рифампином против метициллин-резистентного Staphylococcus epidermidis (MDR-MRSE). Авторы продемонстрировали, что ванкомицин- и рифампин-резистентные MRSE проявляли чувствительность к обоим препаратам, когда все три компонента использовались вместе в комбинации. Механизм синергизма мелиттина, ванкомицина и рифампина еще предстоит выяснить.
Важно отметить, что Zhang et al. сообщили, что характеристики резистентности к препаратам варьируются в зависимости от патогенов и географии, что приводит к дополнительному уровню сложности. Таким образом, разработка синергетических антибиотиков для любого резистентного патогена нуждается в региональной или глобальной многоцентровой валидации.
Хотя антибиотики являются первым выбором клиницистов для лечения бактериальных инфекций, с появлением обширных резистентных к лекарствам патогенов, исследователи нашли несколько альтернатив для уничтожения микробных патогенов (бактериофаги), ослабления их вирулентности (антивируленты) и предотвращения инфекций (вакцины). Yuan et al. сообщили об использовании диметридазола и рибавирина, одобренных для лечения простейших и вирусных инфекций, соответственно, для ослабления вирулентности Pseudomonas aeruginosa. Используя модельную систему Caenorhabditis elegans, авторы продемонстрировали, что диметридазол и рибавирин снижают вирулентность P. aeruginosa, особенно выработку протеаз, и образование биопленок, модулируя систему кворум-сенсинга.
Многократное воздействие сублетальных доз антибиотиков приводит к генетическим изменениям и является основным фактором возникновения резистентности у микроорганизмов. Однако генетические признаки, подтверждающие AMR, крайне неоднородны у различных бактерий. Ни один признак резистентности не является широко консервативным. В то время как резистентные к препаратам внутриклеточные патогены появляются в основном в результате спонтанных мутаций в генах-мишенях, AMR у внеклеточных патогенов в основном обусловлен горизонтальным приобретением генов резистентности. Таким образом, разработка антибиотиков-потенциаторов для нейтрализации функций резистентности требует обширного геномного наблюдения для соответствующей идентификации мишеней и специфических для патогенов подходов к разработке новых потенциаторов или антивирусных препаратов.
В настоящее время в клиниках используется лишь несколько потенцирующих средств, ингибирующих функции бета-лактамаз. Однако потенцирующие средства могут быть разработаны против нескольких целевых молекул, включая:
(i) ферменты резистентности,
(ii) эффлюксные насосы,
(iii) транскрипционные факторы, модулирующие экспрессию генов, связанных с резистентностью, и
(iv) функции, поддерживающие стабильность мобильных генетических элементов, связанных с резистентностью (см.рисунок). Статьи, представленные в данном обзоре, дают представление об открытии препаратов против резистентных патогенов и станут бесценным источником информации для клиницистов и фундаментальных ученых, работающих над борьбой с кризисом резистентности.
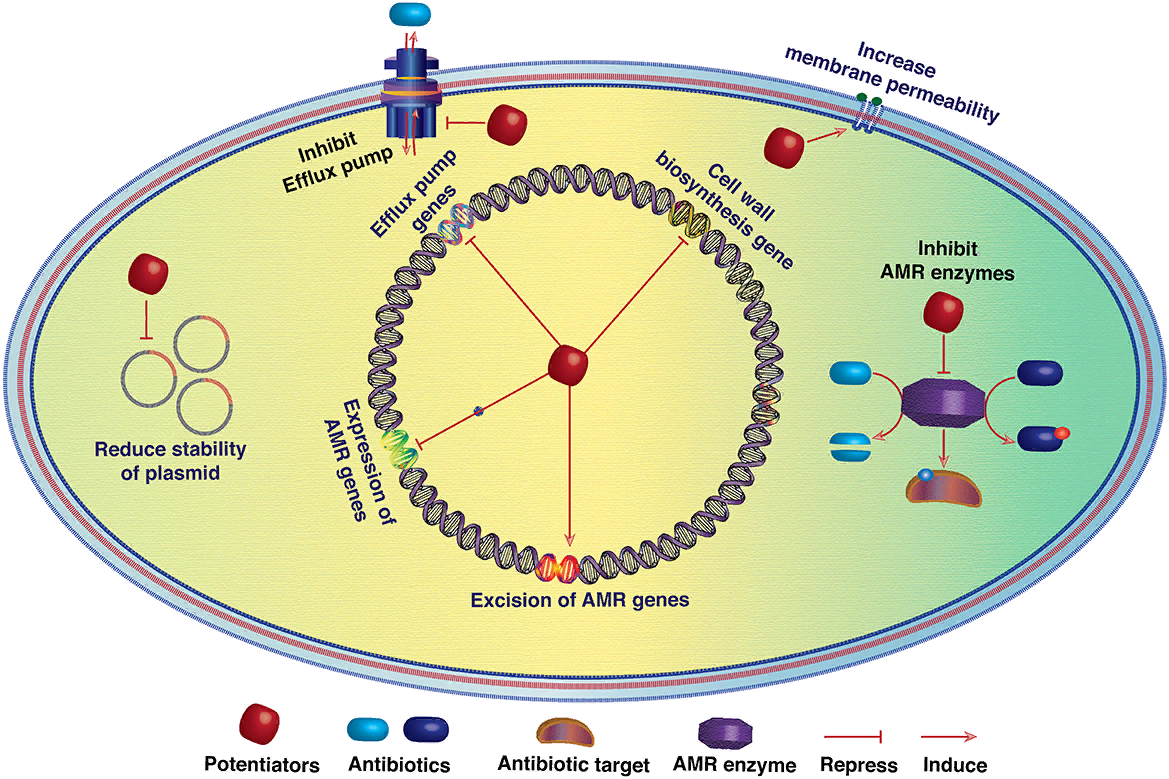
Схематическая диаграмма, показывающая потенциальные мишени антибиотиков-потенциаторов. Потенциаторы могут непосредственно ингибировать активность ферментов резистентности к антибиотикам или снижать активность эффлюксных насосов. Кроме того, модулируя экспрессию генов резистентности к антибиотикам (ARG), потенциаторы могут снижать их клеточный уровень и функции резистентности. Повышение проницаемости мембраны также может способствовать уничтожению антибиотиками резистентных бактерий, достигая порогового уровня. Некоторые мобильные генетические элементы (МГЭ), такие как плазмиды, интегративные конъюгативные элементы и транспозоны, связаны с ARGs. Таким образом, реверсия резистентности к антибиотикам также возможна путем снижения стабильности таких МГЭ.